再生医療を強化するナノマテリアル
人間が撃たれたり刺されたりした後に体を再生できる映画を見たことがない人はいますか?
有名な例は、ウルヴァリンの自己回復の例です。私たちはまだそのような偉業を達成するまでには少し道のりがありますが、科学の進歩を推進するのはまさにこれらのファンタジーである場合があり、おそらくすぐにそれらを実現することができます。
この方向への大きな一歩は、チタン製プロテーゼのように、失われた、または機能しなくなった天然組織に代わる人工組織の製造です。
それでも、私たちの体を再生する際にマーベルのキャラクターのレベルに到達するには、それをワンランク上に上げて、テクノロジーを次のレベルに引き上げる必要があります。そして、私たちは地面にぶつかったようです。
科学者たちは、ナノマテリアルベースのアプローチを使用して細胞の成長、免疫応答、組織のリモデリングを制御することにより、人体が自身の組織を再生するのを助ける新しい戦略を開発しました。
このエキサイティングな新しい科学分野は、再生医療として知られています。 。
それについてもっとお話ししましょう!
ナノマテリアルは再生医療と何の関係がありますか?
以前の記事の1つで、がんの検出と治療のための高度な磁性ナノ粒子 、材料を非常に小さい寸法に縮小すると、根本的に異なる特性を取得できることを確認しました。科学は、これらのナノテクノロジー特性の新しいアプリケーションを見つけるために日々管理しています。
ナノマテリアルの大きな期待の1つは、免疫応答を人間の生体分子(抗体、サイトカイン、ホルモンなど)に結合することによって免疫応答を「調節」する能力です。
しかし、この「変調」とはどういう意味ですか?
免疫応答の制御
免疫システムは私たちの体の軍隊です。そして、他の軍隊と同様に、兵士は攻撃と破壊だけでなく、支援資源としても使用されます。たとえば、免疫システムは、怪我をした後の組織の再生など、あらゆる種類の不測の事態に対処し、代謝毒素や有害な異物を排除することで、環境の不均衡を制御するのに役立ちます。
この制御または変調は、無限の数の生体分子(サイトカイン、インターロイキン、ホルモンなど)によって調整され、その濃度は細胞への信号として機能し、細胞が常にどのように振る舞うべきかを伝えます。
たとえば、火傷を覆うために患者に人工材料を使用する場合、それが最終的に患者の体に組み込まれることが望ましい。具体的には、患者の細胞がコロニーを形成して新しい材料に成長し、最終的には患者自身の組織に置き換わるようにします。
残念ながら、免疫系はしばしば物質を私たちの体にとって異質な存在として認識し、線維症として知られるプロセスを介して線維性結合組織で構成される壁をその周りに作成することによってそれを隔離しようとします。これは細胞には乏しいが、細胞を構造的に支える分子(コラーゲンやフィブリンなどの高分子)が豊富な材料です。元の組織とは大きく異なる特性を持っています。あなたの多くは、通常の皮膚と比較して瘢痕組織がどれほど硬く感じるかを認識するでしょう。関節にある傷跡は、その動きを妨げることさえあります。
<図>
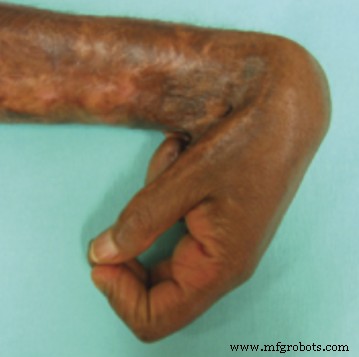
図1関節拘縮を伴う肥厚性瘢痕形成AarabiS、Longaker MT、Gurtner GC(2007)火傷および外傷後の肥厚性瘢痕形成:治療への新しいアプローチ。 PLoS Med 4(9):e234。 doi:10.1371 / journal.pmed.0040234 – http://www.plosmedicine.org/article/info%3Adoi%2F10.1371%2Fjournal.pmed.0040234
前回の記事で強調したPLAからバイオプリンティングへ:医療分野向けのサイエンスフィクションツール 、免疫系によるこの拒絶反応に対処するための戦略は、生体材料を使用して、コラーゲンなどの分子から足場(患者自身の細胞がコロニーを形成する支持構造)を構築することです。残念ながら、コラーゲン繊維のみで構成される足場を移植すると、体はこの物質を再吸収し、最良の場合、線維症に置き換わります。
これは、たとえばヘルニアの後に腹壁を修復するために「人工瘢痕」を作成したい場合に興味を引く可能性があります。使用できるのは、ポリ-4-ヒドロキシ酪酸(P4HB)で作られたPhasix™メッシュで、壁の欠陥を修正します。
インプラントの機能統合を実現するには、細胞の分化を促進し(つまり、各細胞に特定のタイプと機能を与える)、免疫系がインプラントを拒絶する可能性を回避する必要があります。生体分子を送達するための「キャリア」として、またこのプロセスを推進するための信号としてナノマテリアルを使用することで、これを行うことができます。
しかし、これらの生体分子を固定したり、必要な場所に向けたりできるとしたらどうでしょうか?
免疫システムを制御できますか?
たとえば、ナノ材料と抗体の組み合わせを使用して、癌との闘いなどで免疫応答を高めることができます(抗体修飾酸化鉄ナノ粒子)。
一部のナノ材料自体は、免疫応答に対して(材料に応じて)直接的な阻害または刺激効果をすでに持っています(貴金属、金属酸化物ナノ粒子、酸化セリウム、またはデンドリマーがいくつかの例です)。したがって、インプラントの表面をこれらのナノ粒子でコーティングするだけで、実際に免疫系の攻撃を阻止することができます。 [1]
<図>
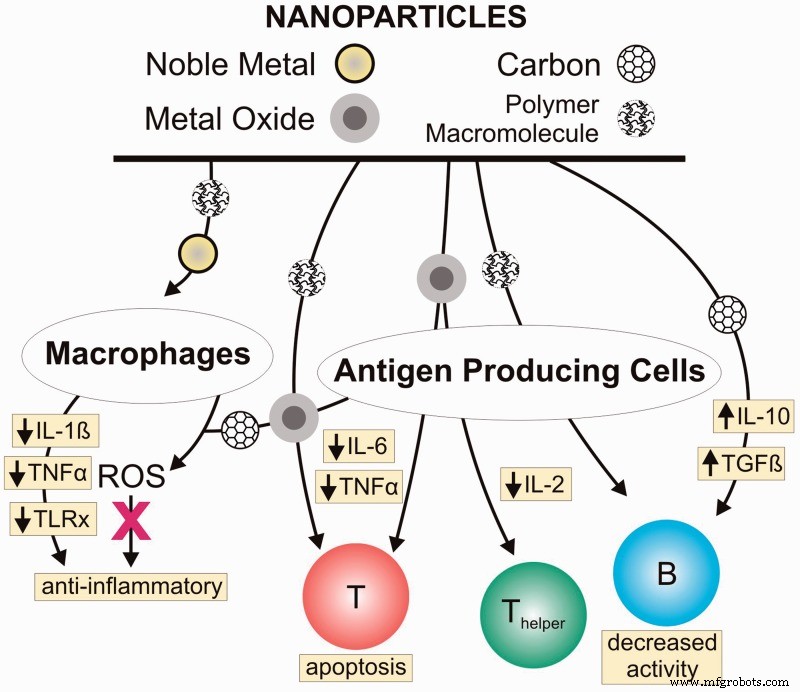
図2免疫応答に直接阻害効果を及ぼすナノ材料NgobiliTerrikaA、Daniele Michael A.ナノ粒子と直接免疫抑制。2016年5月1日実験生物学と医学106巻:241号:10、ページ:1064-1073; https://doi.org/10.1177/1535370216650053 https://journals.sagepub.com/doi/abs/10.1177/1535370216650053
インプラント表面にナノマテリアルと生体分子を固定化するための戦略
すでに述べたように、インプラントの表面をコーティングしたい主な理由は2つあります。生体適合性を高めるため(免疫系が組織を攻撃するのを防ぐため)、または細胞増殖を刺激して指示する生体分子を固定するため(患者自身の組織を移植します。
生分解性の足場(成長因子でコーティングされた)を移植して、時間の経過とともに患者の組織に置き換えるというアイデアは、 PLAからバイオプリンティングへ:医療分野向けのサイエンスフィクションツール> 。このような足場はまだ研究段階にありますが、臨床診療に入る可能性があるのはほんの数年前のことです。

異物の生体適合性を高めることは、業界にとって現在の必要性です。人体が移植された生体材料を拒絶しないようにするために、免疫系を調節するコーティング(ナノ材料または生体分子-ナノ材料複合体)をインプラントの表面に貼り付ける必要があります。したがって、免疫系の細胞がそれに近づきすぎると、コーティングが細胞を抑制し、インプラントの周囲に炎症反応が発生するのを防ぎます。
しかし、どうすればそのようなコーティングを作ることができますか?
コーティングをインプラントに「貼り付ける」には、基本的に2つの方法があります。非共有結合による固定化と共有結合による固定化です。
非共有結合固定化(NCI):
NCIは、インプラントをコーティングするための最も簡単で安価な戦略ですが、インプラント材料の親水性に大きく依存します。これは、注入する材料とコーティングの間に引力を発生させる静電荷に基づいています。
この方法は生体分子の迅速な放出を提供するので、突然であるが短命の反応に関心がある場合に最も便利です。さらに、その最大の利点は、製造コストが低いことです。
NCIは、吸着(表面に付着する500〜1 mmのサイズの小さな粒子)または閉じ込め(多孔質マトリックスに閉じ込められた粒子)のいずれかによって適用できます。 [2]
閉じ込められたマトリックスは、カラギーナン、部分的に加水分解されたコラーゲン(ゼラチン)、アルギン酸塩、寒天、またはセルローストリアセテートなどの水溶性ポリマーで作られています。[2,3]
しかし、インプラント材料が親水性で生体分子が疎水性の場合(またはその逆)はどうなりますか?
1つの簡単なアイデアが効果的な解決策になる可能性があります:生体分子のカプセル化!

アガロース、ポリ(エチレングリコール)(PEG)、またはポリ(N-ビニルピロリドン)(PVP)などのポリマーを使用して簡単に実行できる生体分子の封入へのカプセル化。
この方法の例は、生体分子を注入したアガロースゲル溶液で満たされたポリスルホン足場を使用して、神経線維の再生を誘導し、炎症を軽減することです[4]。
さらに、足場が完全に親水性でない場合、生体分子を固定化するための最良の戦略は、水中油中水(または二重エマルジョン)と呼ばれるプロセスを介して別の水相にそれをカプセル化することです。有機溶剤を使用して、材料の表面に直接吸収することもできます。
ホルモン因子や薬物などの生体分子の固定化に広く使用されている疎水性ポリマーの例は、ポリ(乳酸-co-グリコール酸)(PLGA)です。
共有結合による固定化(CI)
共有結合による固定化は、特定の生体分子と、架橋剤と呼ばれるものを使用してインプラントを作成するポリマーとの間に不可逆的な結合を作成することで構成されます。これらは、物理的条件(熱、光など)に反応し、たとえば、あるポリマー鎖を別のポリマー鎖にリンクできる結合を作成するのに役立つ化合物です(光または熱を使用して閉じられる束縛として想像できます。両方のポリマーをリンクします。
この方法は、はるかに長く持続しますが、免疫系への急激な影響ははるかに少なくなります。したがって、長期的で安定した応答が必要な場合に使用することをお勧めします。
この方法の主な利点は、層状組織の分化を実行できることです。これは、さまざまな要因に対してさまざまな結合点を足場に設計できることを意味します。これにより、さまざまな生体分子濃度の領域を作成して、異なる構造の組織を促進できます。
基本要素として、コラーゲン-グリコサミノグリカン(CG)足場を使用できます(表面にNH2基が遍在しているため、架橋剤としてカルボジイミドを使用します)。
共有結合による固定化の例としては、ポリエチレンイミン(PEI)とヘパリンを結合させてシースを作成し、NiTi合金表面の生体適合性を高めることが挙げられます[5]。
近年重要性を増している架橋方法の1つは、PEGヒドロゲルを重合するためのアクリレートの使用です。アクリレートは紫外線に敏感な官能基です。これらのグループは、ペプチド(または他の成長因子)に追加することができ、したがって、ポリマー-生体分子ハイブリッドで構成される足場の光重合による合成を導きます。このプロセスを3D印刷と統合して足場に構造パターンを与える可能性は、光重合を生体分子を固定化するための最も適切な方法の1つにしています。
代替のフォトリソグラフィープロセスも設計されています。たとえば、フラウンホーファー界面工学およびバイオテクノロジー研究所は、ベンゾフェノン(BP)を使用して成長因子をCG足場に付着させる方法を使用しています。 [6、7]
NH2グループに比べて遍在性が低いため、もう1つのより選択的なターゲットは、SHグループです。スルフヒドリルベースの架橋剤は、グラフトに対する補体(免疫系の非常に重要な成分)の活性化を阻害するコーティングを作成するために広く使用されています[8]。
<図>
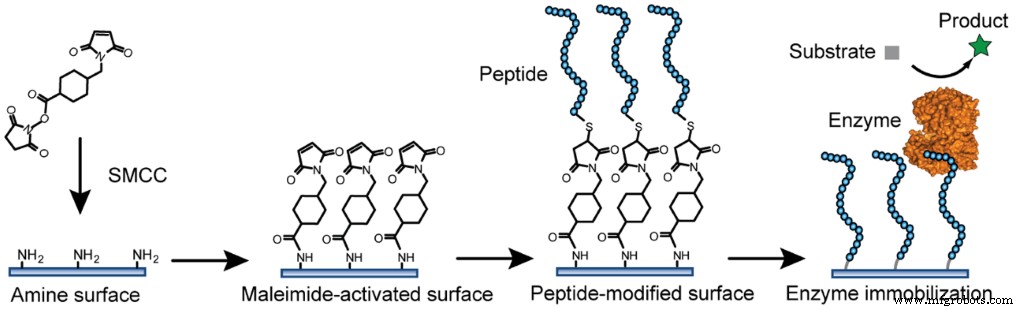
図3共有結合による酵素固定化の例FuJ、Reinhold J、Woodbury NW(2011)酵素固定化のためのペプチド修飾表面。 PLoS ONE 6(4):e18692。 https://doi.org/10.1371/journal.pone.0018692 https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0018692
結論
したがって、明らかに、免疫応答または分化プロセスを制御するために、材料の表面に生体分子を固定化するためのさまざまな戦略があります。
1つの固定化方法を選択する前に、使用する材料の特性と、達成したい生体分子放出プロファイル曲線を知ることが重要です。最良のアプローチは、免疫系が静的な性質を持っていないことを念頭に置いて、さまざまな結合方法の組み合わせです。時間の経過に伴う動的な変化を示しています。
インプラントの生体適合性を増強するためにナノ材料(またはナノ材料-生体分子複合体)を使用するインプラントのコーティングは、今日広く使用されています。ただし、この事実は、カプセル化または結合された生体分子の層状濃度で足場を製造する場合とは著しく対照的です。この分野での膨大な活動にもかかわらず、今日、これらの足場を提供している企業は多くなく、これらの製品を市場に出す前にまだ対処されていない規制措置がたくさんあります。
つまり、完全な瘢痕のない治癒を行うには、もう少し待つ必要があります。しかし、おそらく、待ち時間は長くはないでしょう。この有望な技術は、数年以内に日常の医療現場で使用される可能性があります。
産業技術



