金ナノ粒子のバイオファブリケーションおよび細胞毒性評価のためのArtemisiacapillaris、Portulaca oleracea、およびPrunellavulgaris抽出物の抗酸化能
要約
3つの水性植物抽出物( Artemisia capillaris 、スベリヒユ 、および Prunella vulgaris )金ナノ粒子のバイオファブリケーションに選ばれました。抽出物の抗酸化活性(すなわち、フリーラジカル捕捉活性、総フェノール含有量、および還元力)と、これらの活性が金ナノ粒子のバイオファブリケーションにどのように影響するかを調査しました。 P。尋常性 最高の抗酸化活性を発揮し、次に Aが続きました。キャピラリス 次に P。オレラセア 。 P。尋常性 バイオファブリケーションプロセスで最も効率的な還元剤でした。 Pによってバイオファブリケーションされた金ナノ粒子。尋常性 (PV-AuNPs)は、さまざまな形状で530nmの最大表面プラズモン共鳴を示しました。高分解能X線回折分析は、PV-AuNPが面心立方構造を持っていることを示しました。誘導結合プラズマ発光分光法により、反応収率は99.3%と推定された。流体力学的サイズは45±2nm、ゼータ電位は-13.99mVであると決定されました。 PV-AuNPは用量依存的な抗酸化活性を発揮しました。注目すべきことに、PV-AuNPの最も高い細胞毒性は、ウシ胎児血清の非存在下でヒト結腸直腸腺癌細胞に対して観察されたが、ヒト膵管腺癌細胞については、ウシ胎児血清の存在下で最も高い細胞毒性が観察された。この結果は、 Pであることを示しています。尋常性 抽出物は、癌細胞に対して細胞毒性を発揮する金ナノ粒子のバイオファブリケーションのための効率的な還元剤でした。
はじめに
金属ナノ粒子への関心は、その幅広い用途のために大幅に高まっています[1]。特に、金ナノ粒子(AuNPs)は、薬物/遺伝子送達媒体、触媒、造影剤、および化学的/生物学的センサーとして多くの貴重な用途があります[2]。 AuNPの製造には、イオンスパッタリング、逆ミセル、化学的還元など、さまざまな化学的および物理的方法が利用できます。ただし、これらの方法は、コストと潜在的な毒性に関する懸念によって制限されます。 AuNPのバイオファブリケーション(またはグリーン合成)で植物抽出物を使用することは、他の方法に比べて利点があり、非常に有望な代替手段になります[2]。バイオファブリケーションプロセスは費用効果が高く、スケールアップが簡単です。環境にやさしい素材を使用し、2つの素材(AuNPと植物抽出物)の活性を組み合わせることで相乗効果を発揮します。バイオファブリケーションは、合成中に有害な化学還元剤を導入しないため、プロセスが完全にグリーンになります。さらに、この機能により、結果として得られるAuNPの生体適合性が向上し、安定性が向上します。植物抽出物に由来するさまざまな植物化学物質は、還元剤としてだけでなく、キャッピングおよび安定剤としても使用されています[3]。
カワラヨモギ アルテミシア属に属する 、キク科の最大の属の1つです[4]。古くから、 A。キャピラリス 抗菌、抗炎症、抗酸化、肝保護などのさまざまな薬理作用により、漢方薬として広く使用されています。以前の研究では、これらの影響は Aの有効成分に起因するとされていました。キャピラリス 、カピリン、カピレン、スコパロン、およびβ-シトステロールを含む[4,5,6]。 スベリヒユ スベリヒユ科の毎年恒例の多肉植物は、抗菌、抗真菌、抗炎症、抗酸化、および抗潰瘍作用などのさまざまな薬理学的効果を示します。これらの効果は、アルカロイド、脂肪酸、フラボノイド、多糖類、テルペノイドなどのさまざまな有効成分に起因することが実証されています[7、8]。 Prunella vulgaris シソ科の多年生草本植物です。多くの研究が、 Pの抗ウイルス作用[9]、抗癌作用[10]、免疫調節作用[11]、抗酸化作用[11、12]、および血糖降下作用[13]を示しています。尋常性 。これらの効果に寄与する主な有効成分は、有機酸、フェノール酸、およびリノレン酸、パルミチン酸、シス-を含むトリテルペノイドです。 および trans- コーヒー酸、ロスマリン酸、オレアノール酸、およびウルソール酸[14]。
「タンパク質コロナ」のために、ナノ粒子研究におけるinvitroとinvivoの結果の間に大きなギャップがしばしば存在します。生物学的環境に入ると、ナノ粒子の表面は、タンパク質コロナと呼ばれる多様なタンパク質のコーティングで覆われるようになります[15]。タンパク質コロナでコーティングされたナノ粒子は細胞に入り、細胞の取り込み、細胞毒性、生体内分布、排泄、細胞応答、薬物放出、および治療効率に影響を与えます[16]。興味深いことに、金属ナノ粒子の形状、サイズ、表面電荷、表面粗さなどの物理化学的特性は、タンパク質コロナを形成する際の血清タンパク質吸着に大きく影響します[17]。 Shannahanらは、銀ナノ粒子(AgNP)でのタンパク質コロナの形成が、ラットの肺上皮細胞およびラットの大動脈内皮細胞に対する細胞毒性を経由で媒介することを報告しました。 スカベンジャー受容体[18]。血清アルブミンは、抗菌および細胞毒性効果を低下させることにより、ヒドロゲルに埋め込まれたコロイド状AgNPに影響を与えます[19]。
本報告では、 Aの水性抽出物のフリーラジカル捕捉活性、総フェノール含有量、および還元力を含む抗酸化活性を評価しました。キャピラリス 、 P。オレラセア 、および P。尋常性 。続いて、これら3つの抽出物を使用したAuNPのバイオファブリケーションを実施し、抽出物の抗酸化活性がコロイド溶液の色とAuNPの表面プラズモン共鳴(SPR)バンドの形状にどのように影響するかを調べました。以降、バイオファブリケーションされたAuNPは、各植物の学名にちなんで名付けられます。 Aの抽出物を使用して得られたAuNPです。キャピラリス Pの抽出物を使用して得られたAuNPであるAC-AuNPと呼ばれます。オレラセア PO-AuNPと呼ばれ、 Pの抽出物を使用して得られたAuNP。尋常性 PV-AuNPと呼ばれます。 Pの抗酸化活性。尋常性 抽出物が最高でした。したがって、我々は、UV-可視分光光度法、高分解能透過型電子顕微鏡法(HR-TEM)、高分解能X線回折(HR-XRD)、誘導結合プラズマなど、さまざまな分光法および顕微鏡法によってPV-AuNPの特性を明らかにしました。発光分光法(ICP-OES)。 PV-AuNPの流体力学的サイズは、ゼータ電位とともに動的光散乱(DLS)によって測定されました。さらに、2,2-ジフェニル-1-ピクリルヒドラジル(DPPH)ラジカル捕捉活性をモニタリングすることにより、PV-AuNPの抗酸化活性を調べました。 3つの癌細胞に対する細胞毒性は、細胞培養におけるウシ胎児血清(FBS)の存在下または非存在下での水溶性テトラゾリウム(WST)アッセイによって調査されました。次の癌細胞を使用しました:ヒト結腸直腸腺癌(HT-29)、ヒト乳房腺癌細胞(MDA-MB-231)、およびヒト膵管腺癌細胞(PANC-1)。
メソッド
資料
塩化カリウム金(III)(KAuCl 4 )、ブチル化ヒドロキシトルエン(BHT)、リン酸ナトリウム一塩基性、リン酸ナトリウム二塩基性、トリクロロ酢酸、フォリン-シオカルトのフェノール試薬、炭酸ナトリウム、没食子酸、酒石酸ナトリウムナトリウム、重炭酸ナトリウム、硫酸、2,2'-アジノ-ビス- 3-エチルベンズチアゾリン-6-スルホン酸(ABTS)、過硫酸カリウム、およびd-(+)-グルコースは、Sigma-Aldrich(St。Louis、MO、USA)から購入しました。 DPPHはAlfaAesar(Ward Hill、MA、USA)から購入しました。ヘキサシアノ鉄酸カリウム(III)は和光(大阪、日本)から入手した。硫酸ナトリウム、ヘキサアンモニウムヘプタモリブデート四水和物、およびヒ酸水素二ナトリウム七水和物は、Junsei(東京、日本)から購入しました。塩化鉄(III)はDuksan(京畿道、韓国)から入手し、硫酸銅五水和物はDeajeng(京畿道、韓国)から入手しました。他の試薬は分析グレードのものであり、受け取ったままの状態で使用されました。高グルコースダルベッコ改変イーグル培地(DMEM)、ペニシリン-ストレプトマイシン(10,000 U / mL)、トリプシン-EDTA(0.5%、フェノールレッドなし)、およびリン酸緩衝生理食塩水(PBS)は、Gibco(Thermo Fisher Scientific、 MA、USA)。 FBSは、GE HealthcareHyClone™(オーストラリア、ビクトリア州)から入手しました。
楽器
Shimadzu UV-2600分光光度計を使用して、UV-可視スペクトルを取得し、SPRを観察しました(島津製作所、京都、日本)。粒子サイズと形状に関する情報は、HR-TEM画像から得られました。 HR-TEM画像を取得するために、200 kVで動作するJEM-2100F機器が使用されました(JEOL、東京、日本)。 PV-AuNPのコロイド溶液を、カーボンコーティングされた銅グリッド(カーボンタイプB、300メッシュ、Ted Pella、米国カリフォルニア州レディング)にロードしました。サンプルをロードしたグリッドを周囲温度で風乾しました。リガクミニフレックス回折計(40 kV、30 mA)を使用して、CuKα放射線源(λ)でHR-XRDパターンを取得しました。 =1.54056Å)10ºから80°の範囲(2 θ スケール)(リガク、日本)。 FD5505凍結乾燥機を使用して、HR-XRD分析用の粉末サンプルを調製しました(Il Shin Bio、ソウル、韓国)。反応収率を推定するために、Perkin Elmer Optima 8300装置(米国マサチューセッツ州ウォルサム)でICP-OESを実施しました。遠心分離を行った(18,500 g 力、7時間、18°C)、および上清を収集しました。 2つのサンプル、つまりコロイド状PV-AuNP溶液と上澄みを、ICP-OES分析にかけました。遠心分離にはエッペンドルフ5424R遠心分離機を使用しました(エッペンドルフAG、ハンブルグ、ドイツ)。流体力学的サイズとゼータ電位は、NanoBrook 90 Plusゼータアナライザー(Brookhaven Instruments Corporation、米国ニューヨーク州ホルツビル)によって測定されました。
Aの水性抽出物の調製。キャピラリス 、 P。オレラセア 、および P。尋常性
Pの乾燥した空中部分。尋常性 および A。キャピラリス 花と葉を含む、はオムニハーブ(大邱、大韓民国)、および Pから購入しました。オレラセア Handsherb(Youngchun、Republic ofKorea)から入手しました。各植物の地上部の水性抽出物は、超音波処理(WUC-A22H、大韓民国、大韓民国)によって調製された。各植物について、100 gの刻んだ植物を脱イオン水(1000 mL)で3回抽出しました。抽出手順には、25°Cで3時間の植物の超音波処理が含まれていました。水性抽出物を濾過し、濾液を真空凍結乾燥機(FD8518、IlShinBioBase Co. Ltd.、大韓民国)で凍結乾燥した。最後に、各植物の抽出粉末を入手し、使用前に-20°Cで保存しました。
DPPHラジカルスカベンジングアクティビティ
96ウェルマイクロプレートの各ウェルで、20μLの各抽出物をエタノール中のDPPHラジカル溶液(0.1 mM、180μL)と混合して、抽出物のいくつかの最終濃度(31.25μg/ mL、62.5μg/ mL、 125μg/ mL、および250μg/ mL)。プレートを暗所で周囲温度で30分間インキュベートした後、マルチ検出リーダー(Synergy HT、BioTek Instruments、Winooski、VT、USA)を使用して各ウェルの吸光度を517nmで測定しました。 BHTを標準として使用しました。すべての実験は3回行った。各サンプルの吸光度からAuNPの吸光度を差し引いて、517nmでのAuNPの固有の吸光度を排除しました。
ABTSラジカルスカベンジングアクティビティ
ABTSラジカルカチオンは、1:1( v / v )の反応によって調製されました。 )7.4 mMABTS溶液と2.6mM過硫酸カリウム溶液を、暗所、周囲温度で24時間混合します。 ABTSラジカル溶液は、測定のために730nmで0.74の吸光度になるようにエタノールで希釈されました。 96ウェルマイクロプレートの各ウェルで、エタノール中のABTSラジカル溶液(180μL)を各抽出物の20μLに添加しました(抽出物の最終濃度、15.63μg/ mL、31.25μg/ mL、62.5μg/ mL、および125μg/ mL)。暗所で周囲温度で10分間インキュベートした後、マルチ検出リーダーを使用して各ウェルの吸光度を730nmで測定しました。ビタミンCの溶液を標準として調製しました。すべての実験は3回行った。
電力の削減
さまざまな濃度の抽出物の等量(500μL)を0.2 Mリン酸緩衝液(pH 6.6、500μL)および1%ヘキサシアノ鉄酸カリウム(III)(500μL)と混合しました。抽出物の最終濃度は、52.1 µg / mL、104.2 µg / mL、208.3 µg / mL、および416.7 µg / mLでした。各混合物を50℃でインキュベートしました。 20分後、トリクロロ酢酸(10%、500μL)を混合物に加え、3400 g で遠心分離しました。 10分間力を加えます。次に、塩化鉄溶液(0.1%、100μL)を500μLの上清に加えました。 10分後、マルチ検出リーダーを使用して、700nmで反応混合物の吸光度を測定しました。 BHTを標準として使用しました。すべての実験は3回行った。
総フェノール含有量
抗酸化活性とフェノール化合物の含有量との関係を調べた。 20マイクロリットルの抽出物を100μLのフォリン-チオカルト試薬(脱イオン水で10倍に希釈)および80μLの炭酸ナトリウム(7.5%、 w / v )と混合しました。 )。反応は、暗所、周囲温度で実施した。 30分後、765 nmでの吸光度を測定し、没食子酸で作成した検量線を使用して総フェノール含有量を決定しました。すべての決定は3回行った。
PO-AuNP、AC-AuNP、およびPV-AuNPのバイオファブリケーション
バイオファブリケーション反応の前に、塩化カリウム金(III)(10 mM)と抽出物(2%、 w / v )の2つのストック溶液を調製しました。 )。各抽出物のストック溶液(2%)を遠心分離しました(18,500 g 力、30分、18°C)。上澄みを集め、バイオファブリケーション反応に利用した。最終濃度は、0.5 mM塩化カリウム金(III)および0.05%( w / v )に調整されました。 )AuNPのバイオファブリケーション用に2mLガラスバイアルで抽出します。 Au塩を抽出物と混合した後、37°Cでドライオーブン内で5時間インキュベーションを行いました。次に、300〜800nmの範囲でUV-可視スペクトルを取得しました。
細胞培養
3つの癌細胞(HT-29、PANC-1、およびMDA-MB-231)は、Korean Cell Line Bank(ソウル、大韓民国)から購入しました。細胞は、10%FBS、ペニシリン(100ユニット/ mL)、およびストレプトマイシン(100μg/ mL)を添加した高グルコースDMEMで培養しました。細胞を37°Cで培養しました(5%CO 2 を供給) )インキュベーター内で、トリプシン処理前に約80%のコンフルエンスを維持しました。
細胞毒性
DoGenBio(京畿道、韓国)のEZ-CYTOXキットを使用して、癌細胞に対する細胞毒性を評価するWSTアッセイを行いました。細胞を96ウェルプレートに5.0×10 3 の密度で播種しました。 細胞/ウェル。 CO 2 の下で37°Cのインキュベーター内で24時間、インキュベーションを行いました。 (5%)雰囲気。インキュベーション後、培地を廃棄した。次に、さまざまな濃度のPV-AuNP(ICP-OES分析で測定されたAu濃度に基づいて0、29.9、59.8、119.6、239.2、および478.3μg/ mL)を、培地を含む細胞に添加しました。 FBSの欠如。インキュベーター内で37°Cでさらに24時間インキュベートした後、EZ-CYTOX試薬(10μL)を添加し、細胞をCO 2 でインキュベートしました。 さらに1時間インキュベーター。 Cytationハイブリッドマルチモードリーダー(BioTek Instruments、Winooski、VT、USA)を使用して、450nmで吸光度を測定しました。 PV-AuNPの固有の吸光度は、450nmでの細胞毒性の測定を妨害しました。したがって、PV-AuNPのバックグラウンド吸光度は、450nmで測定された各データポイントの吸光度から差し引かれました。 PV-AuNPのバックグラウンド吸光度は、WSTを含まない条件で測定されました。さらに、PV-AuNPの代わりに、同量の脱イオン水をコントロールとして使用しました。
統計分析
すべての実験は3回行われ、結果は平均±標準誤差(SE)として表されます。差異の有意性は、ANOVA(一元配置分散分析)とそれに続くテューキーの多重比較検定またはニューマン=コイルス多重比較検定を使用して調査されました。統計分析は、GraphPad Software(GraphPad Softwareバージョン5.02、米国カリフォルニア州サンディエゴ)を使用して計算されました。結果は、 p の値に対して統計的に有意であると見なされました。 <0.05。
結果と考察
抽出物の抗酸化作用
各植物の地上部の水性抽出物は、超音波処理によって得られた。 Aの抽出収率。キャピラリス 、 P。オレラセア 、および P。尋常性 それぞれ14.1%、39.12%、28.6%でした。最高の抽出収率は Pで示された。オレラセア 、その後に Pが続きます。尋常性 そして最後に Aによって。キャピラリス 。抽出物の抗酸化活性を評価するために、フリーラジカル捕捉活性、還元力、および総フェノール含有量を測定しました。抽出物のフリーラジカル捕捉活性は、DPPHおよびABTSアッセイによって決定されました。 DPPHラジカルは安定したフリーラジカルであり、抗酸化剤によって還元されると吸光度が失われるため、DPPHはフェノール化合物の抗酸化活性を評価するために広く使用されています。 ABTSアッセイは、強力な酸化剤とABTSの反応によって生成されるラジカルを除去する抗酸化剤の能力を測定します。水素供与性を有する抗酸化剤によるABTSラジカルの吸光度の低下を評価します。水性抽出物は、用量依存的に除去活性を示した。テストした濃度(15.63μg/ mL、31.25μg/ mL、62.5μg/ mL、125μg/ mL、および250μg/ mL)で、 Pの抽出物。尋常性 (IC 50 DPPHラジカルに対して50.35±1.22μg/ mL; IC 50 ABTSラジカルに対して38.6±0.44μg/ mL)は、DPPHおよびABTSラジカルに対して最も強力な活性を示し、次に Aの抽出物が続きました。キャピラリス (IC 50 DPPHラジカルに対して156.72±0.97μg/ mL; IC 50 ABTSラジカルに対して147.28±2.95μg/ mL)、次に Pの抽出物。オレラセア (IC 50 DPPHラジカルに対して247.33±1.57μg/ mL; IC 50 ABTSラジカルに対して305.54±4.86μg/ mL)。特に、 P。尋常性 BHTよりも強力なDPPHフリーラジカル捕捉活性を示しました(IC 50 71.37±0.84μg/ mL)、これは標準として使用されました(表1および図1a、b)。 Pの抽出物。尋常性 3つの抽出物の中で最も高いDPPHおよびABTSラジカル捕捉活性を示しました。この結果は、おそらくより多くの抗酸化化合物が Pに存在することを意味した。尋常性 Aより。キャピラリス および P。オレラセア。
<図>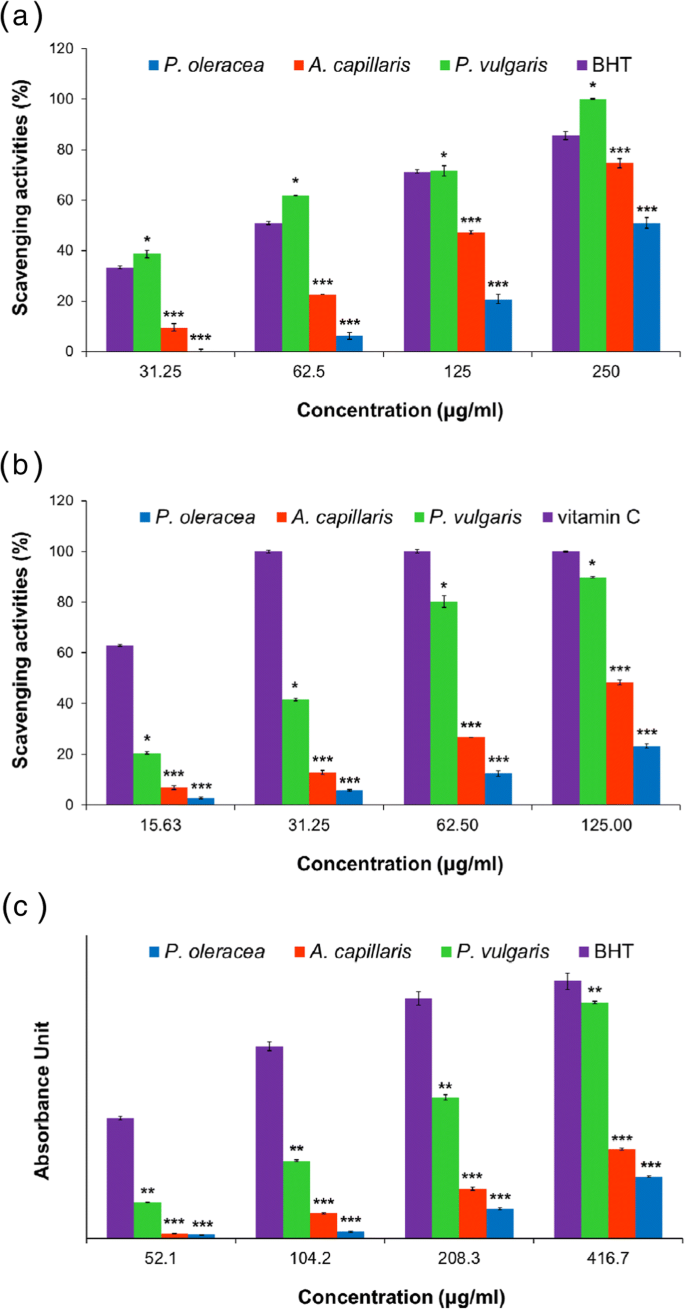
Aの水性抽出物のDPPHおよびABTSラジカル捕捉活性および還元力。キャピラリス 、 P。オレラセア 、および P。尋常性 。 a DPPHラジカル捕捉活性。 b ABTSラジカル捕捉活動。 c 抽出物の還元力。データは平均±SEMとして表されます。アスタリスクは、標準(BHTまたはビタミンC)との違いの重要性を示しています:* p <0.05、** p <0.01、*** p <0.001。結果は、3つの独立した実験を表しています
また、抽出物の抗酸化活性を経由で調べました。 還元力アッセイ。抗酸化剤の存在下で、フェリシアン化カリウム(Fe 3+ )はフェロシアン化カリウム(Fe 2+ )に変換されます )、これは塩化第二鉄と反応して第二鉄-鉄錯体を形成します。第二鉄-鉄錯体は700nmで最大吸光度を示し、これを使用して抗酸化剤の還元力を評価できます。現在のレポートでは、還元力は700 nmで0.7の吸光度を示した各抽出物の濃度(μg/ mL)として表されています。図1cに示すように、 P。尋常性 (162.98μg/ mL)は Aよりも著しく高い還元力を発揮しました。キャピラリス (235.38μg/ mL)および P。オレラセア (396.16μg/ mL)。前に述べたように、電力を減らした結果は、おそらくより多くの抗酸化化合物が Pに存在するであろうことも示した。尋常性 Aより。キャピラリス および P。オレラセア。
各抽出物の総フェノール含有量も調査されました。フェノール化合物が潜在的な抗酸化剤であり、それらのヒドロキシル基のためにラジカルを除去する能力を持っていることはよく知られています。したがって、植物抽出物の抗酸化活性は、そのフェノール含有量とよく相関する可能性があります。没食子酸を使用して標準の検量線を作成しましたが、この曲線は線形関係( y )を示しました。 =6.0617 x + 0.1293、 r 2 =0.9983)。標準曲線を使用して、総フェノール含有量が計算され、抽出物1グラムあたりの没食子酸当量(GAE)のミリグラムとして表されます。抽出物の総フェノール含有量は、 Pで90.53±6.81mgGAE / gでした。尋常性 、39.88±4.55 mg GAE / g( Aの場合)。キャピラリス 、および Pの場合は18.32±2.76mgGAE / g。オレラセア 。総フェノール含有量は Pで最も高かった。尋常性 3つの抽出物の中で。
総フェノール含有量と、ラジカルを除去する抽出物の能力またはそれらの還元力との間には正の相関関係がありました。まとめると、 Aの水性抽出物。キャピラリス 、 P。オレラセア 、および P。尋常性 顕著な抗酸化活性を示した。特に、 Pの抽出物。尋常性 DPPHラジカルとABTSラジカルの両方に対して最大のラジカル捕捉活性、最強の還元力、および最高の総フェノール含有量を示しました。これは、 Pの抽出物を意味します。尋常性 AuNPのバイオファブリケーションの還元剤として最も強力な活性を発揮します。 3つの抽出物を使用したAuNPのバイオファブリケーションのこれらの興味深い結果については、次のセクションで説明します。
AC-AuNP、PO-AuNP、およびPV-AuNPのバイオファブリケーション
抽出物の抗酸化活性がAuNPのバイオファブリケーションプロセスに強く影響することを提案しました。抗酸化活性は、Au塩をAuNPに還元する際の主要な推進力であるため、 P。尋常性 最高の抗酸化活性を持つ、は最も効率的な還元剤になることができます。 AuNPは可視-近赤外波長範囲で特徴的なSPRを持っているため、バイオファブリケーションプロセスの後にUV-可視分光光度法が続きました。 AuNPのバイオファブリケーションは、Au塩を各抽出液と混合することによって実行されました。各抽出物には、Au塩をAuNPに還元するのに非常に効率的な多様な植物化学物質が含まれていました。
AuNPの明確なSPRバンドにより、最初は淡黄色の溶液の色が、PO-AuNPの場合は濃い青、AC-AuNPの場合は蛍光茶色、PV-AuNPの場合はワインレッドに変化しました(図2)。 。乾燥オーブン内で37°Cで5時間インキュベートした後、UV-可視スペクトルを記録して、AuNPの各セットの個別のSPRバンドを観察しました(図3)。最大吸光度は、PV-AuNPでは530 nm、AC-AuNPでは555nmで観察されました。 PO-AuNPの場合、500〜700nmの広いSPRバンドが観察されました。 3つの抽出物は、UV-可視スペクトルに特徴的なSPRバンドを持つAuNPを生成しました。それぞれの色の変化は、明確なSPRバンドとともに、各抽出物によるAuNPのバイオファブリケーションの成功を明確にサポートしていました。抗酸化作用に関連する3つの要因(フリーラジカル捕捉活性、総フェノール含有量、および還元力)がAuNPバイオファブリケーションに影響を与えることを提案しました。 Pの抽出物。尋常性 3つの要素すべてで最高のスコアを獲得し、次に Aが続きました。キャピラリス そして最後に Pによって。オレラセア 。興味深いことに、PO-AuNPは、周囲温度(25°C)で30分間保存した後に凝集することが示されました。この結果は、PO-AuNPが、抗酸化活性、総フェノール化合物の量、および Pの還元力として、最も不安定であることを示唆しました。オレラセア これら3つの抽出物の中で最低でした。対照的に、PV-AuNPは最高の吸光度と透明なワインレッド溶液を示しました。 AC-AuNPの吸光度は、PO-AuNPとPV-AuNPの吸光度の間にありました。したがって、これらの観察に基づいて、より高いフリーラジカル捕捉活性、総フェノール含有量、および Pの還元力が決定された。尋常性 抽出物は、 Aの抽出物によって生成されたAuNPと比較してより安定したAuNPの合成をもたらした。キャピラリス および P。オレラセア 。まとめると、最大SPRバンドは、抽出物の抗酸化活性の低下に伴い、深色シフトと浅色シフトを示しました。さらに、SPRバンドの形状は、抗酸化活性の低下とともに広がる傾向がありました。したがって、PV-AuNPは、HR-TEM、HR-XRD、流体力学的サイズ、およびゼータ電位測定によってさらに特徴づけられました。反応収率を決定するために、ICP-OES分析を実施しました。 FBSの存在下/非存在下での抗酸化活性と細胞毒性を癌細胞に対してさらに評価しました。

PO-AuNP、AC-AuNP、PV-AuNPのデジタル写真
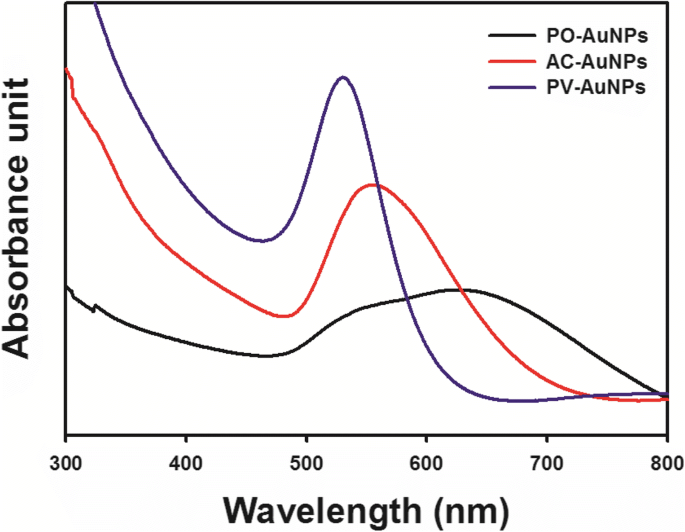
PO-AuNP(黒線)、AC-AuNP(赤線)、PV-AuNP(青線)のUV-可視スペクトル
PV-AuNPのHR-TEM画像
顕微鏡技術は、ナノ粒子を視覚化するための最も効果的なツールです。 HR-TEMに加えて、走査型電子顕微鏡法と原子間力顕微鏡法は、サイズ、形態、トポグラフィー、および2次元/ 3次元構造を決定するために一般的に利用されています。 PV-AuNPのサイズと形態をHR-TEMで調べた。図4に示すように、球、三角形、棒、ひし形、六角形など、さまざまな形が観察されました(図4a〜e)。ロッド(図4f、g)と三角形(図4h)の格子構造を観察すると、PV-AuNPが本質的に結晶性であることが明確に示されました。この結果は、その後のHR-XRD分析結果によって強く支持されました。各粒子形状のサイズはHR-TEM画像から測定され、結果のサイズヒストグラムが図5に示されています。すべてのヒストグラムはガウス分布を示しています。画像内の個別のナノ粒子をランダムに選択して、各形状の平均サイズを取得しました。球の直径は、250個のナノ粒子から23.8±1.3 nmであると決定されました(図5a)。興味深いことに、正三角形が作成されました。したがって、64個のナノ粒子の高さを測定しました(25.7±2.2 nm、図5b)。 27個の棒状のナノ粒子をランダムに選択して、平均の長さを決定しました(28.4±0.4 nm、図5c)。ロッドの長さを幅で割ったものとして定義される平均アスペクト比は、2.4であると決定された。ひし形は、画像からランダムに38個のひし形を選択しました。図5d、eに示すように、長い対角線と短い対角線の平均の長さは、それぞれ22.0±0.6nmと15.4±0.3nmと測定されました。多様な形状のPV-AuNPのサイズは30nm未満であり、次のセクションでサイズを流体力学的サイズと比較しました。
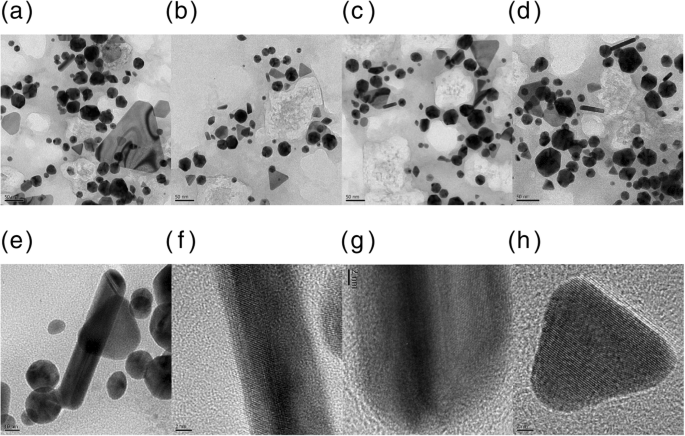
PV-AuNPのHR-TEM画像。スケールバーは a を表します 50 nm、 b 50 nm、 c 50 nm、 d 50 nm、 e 10 nm、 f 2 nm、 g 2 nm、および h 2 nm
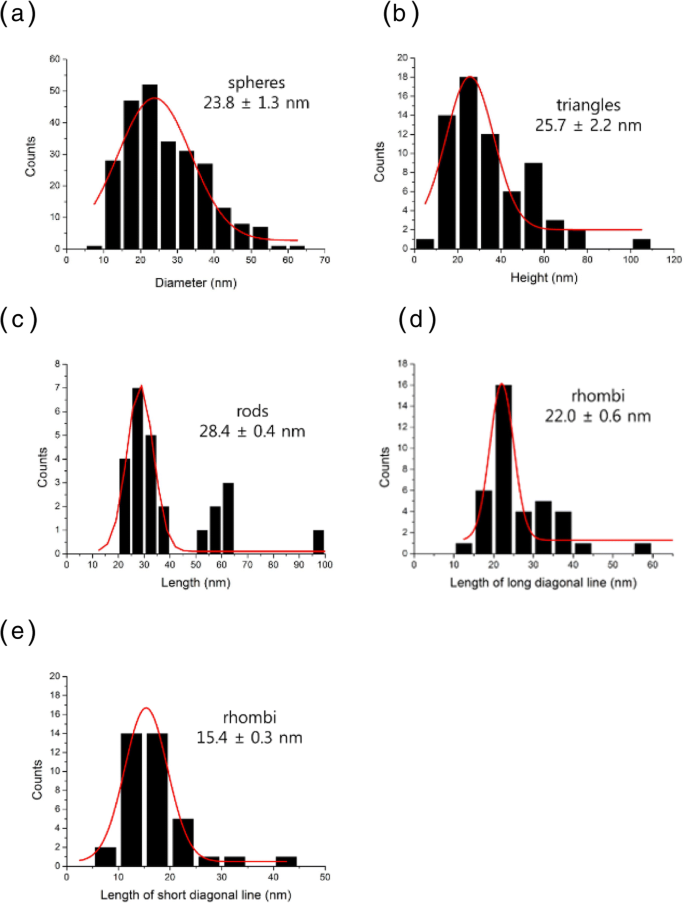
PV-AuNPのサイズヒストグラム。 a 球の直径。 b 正三角形の高さ。 c ロッドの長さ。 d ひし形の長さ(長い対角線)。 e ひし形の長さ(短い対角線)
PV-AuNPの流体力学的サイズとゼータ電位
流体力学的サイズとゼータ電位は、さらなるアプリケーションのためのナノ粒子研究における重要な特性です。一般に、流体力学的サイズはナノ粒子の表面に結合した生体分子を反映しているため、HR-TEM画像から測定されたサイズは流体力学的サイズよりも小さくなります。図6aに示すように、流体力学的サイズは45±2 nmであり、多分散度指数は0.258であり、HR-TEM画像から測定された球のサイズ(250ナノ粒子から23.8±1.3 nm)よりも大きかった。 。この結果は、抽出物中の植物化学物質がPV-AuNPの表面に結合し、それらを安定化させたことを明確に示唆しています。さらに、PV-AuNPは-13.99 mVの負のゼータ電位を持っていました(図6b)。これらの結果は、負電荷を持つ植物化学物質が負のゼータ電位に寄与している可能性が最も高いことを示しています。この負のゼータ電位は、PV-AuNPのコロイド溶液に反発力を与え、その安定性をもたらします。したがって、私たちの将来の作業の1つには、 Pの抽出物の植物化学的スクリーニングが含まれます。尋常性 負のゼータ電位に寄与する正確な化合物を解明するため。
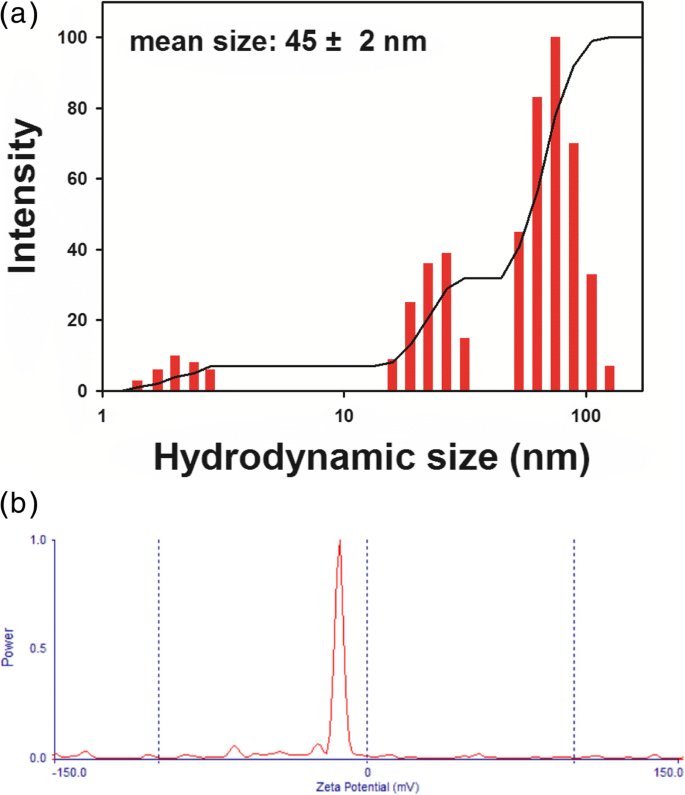
PV-AuNPの流体力学的サイズとゼータ電位。 a 流体力学的サイズ。 b ゼータ電位
PV-AuNPのHR-XRD分析
X線回折分析は、一般的に金属ナノ粒子に関する結晶学的情報を取得するために使用されます。 HR-XRDから得られたブラッグ反射に関する特徴的な回折パターンは、PV-AuNPが結晶構造を持っていることを示しました。回折ピーク(2 θ 値)38.1°、44.5°、64.8°、および77.4°で観察された値は、PV-の面心立方構造の(111)、(200)、(220)、および(311)面にそれぞれ対応しました。 AuNP(図7)。シェラー方程式( D =0.89・λ/ W・cos θ )を使用して、PV-AuNPのおおよそのサイズを決定しました。方程式に適用するために、最も強い(111)ピークを選択しました。方程式の各項の定義は次のとおりです。 D は、(111)ピークθから決定されたPV-AuNPのサイズです。 (111)ピークのブラッグ回折角λ は使用されたX線波長であり、Wはラジアン単位の(111)ピークの半値全幅(FWHM)です。シェラーの式から、PV-AuNPのおおよそのサイズは16.7nmであると決定されました。シェラー方程式から決定されたサイズは、HR-TEM画像と流体力学的サイズの両方から測定されたサイズよりも小さかった。おそらく抽出物中の植物化学物質がPV-AuNPの表面に結合したという事実のために、流体力学的サイズが最大でした。
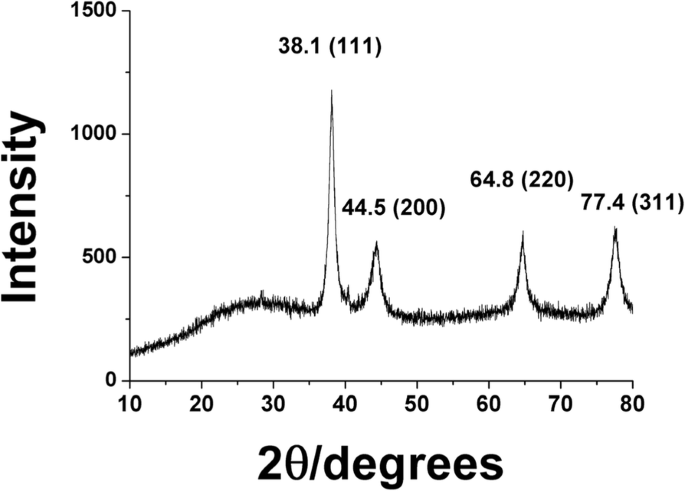
PV-AuNPのHR-XRD分析
PV-AuNPの反応収率
ICP-OESを使用して反応収率を推定しました。まず、PV-AuNP溶液を分析してAuの総濃度を求めた。次に、PV-AuNPを遠心分離し、上清を回収しました。上澄みを分析して、還元反応における未反応のAuの濃度を確認した。次に、反応収率を次のように推定した:反応収率(%)=100 − [上澄み中のAu濃度/コロイド溶液中のAu濃度]×100。
ICP-OES分析に基づいて、コロイド状PV-AuNP溶液と上澄み中のAuの濃度は、それぞれ96.337ppmと0.679ppmであると決定されました。したがって、PV-AuNPの反応収率は99.3%であると決定された。 ICP-OESの結果から、PV-AuNPの高い反応収率をもたらす反応条件が最適であると結論付けました。
PV-AuNPの抗酸化活性
PV-AuNPの抗酸化活性を評価するために、DPPHラジカル捕捉活性を調べました。図8に示すように、PV-AuNPのDPPHラジカル捕捉活性は、20.9μg/ mL未満の濃度(Au濃度に基づく)でほぼ一定でした。ただし、濃度が高くなると(Au濃度に基づいて41.9〜334.8μg / mL)、DPPHラジカル捕捉活性も高くなり、活性が用量依存的であることが示唆されました。 IC 50 PV-AuNPの割合は165.0μg/ mLであることが観察されました。これはIC 50 と同等です。 ビタミンC(49.4μM)
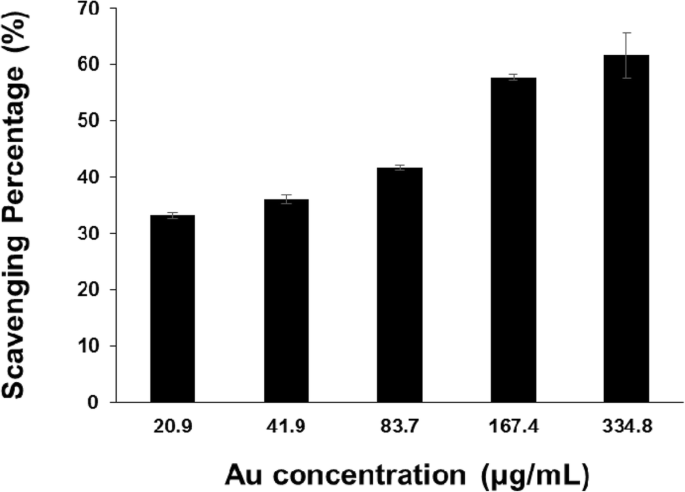
PV-AuNPのDPPHラジカル捕捉活性。濃度はAu濃度として表されました
緑で合成されたAuNPまたはAgNPは、DPPHラジカル捕捉活性に関して抗酸化活性を有することが知られています[20、21]。高麗人参を介したAuNPは抗酸化作用を示しました[20]。表面積の大きいナノ粒子の表面での高麗人参ベリー抽出物への植物化学物質の吸収は、AuNPの抗酸化活性によるものと考えられます[20]。 Angelica pubescens を使用して緑色で合成されたAuNP 根は用量依存的に抗酸化活性を示しました[21]。 Aの二次代謝産物。 pubescens フラボノイド、セスキテルペン、フェノール化合物などは、フリーラジカル捕捉活性の潜在的な要因です[21]。ただし、上記の2つの記事では、AgNPはAuNPよりも高い抗酸化活性を示しました。
PV-AuNPの細胞毒性
異なる組織タイプ(結腸、膵臓、乳房)の3つの癌細胞に対するPV-AuNPの細胞毒性を評価して、FBSの存在下/非存在下でのナノ粒子の組織特異的細胞毒性を調べました(図9)。細胞培養中に血清が存在すると、さまざまな種類のタンパク質コロナが形成されました。タンパク質コロナは、サイズ、形状、表面電荷、表面粗さなどのナノ粒子の特性に依存していました[22]。タンパク質コロナは、ナノ粒子の細胞への取り込みと細胞毒性を増加または減少させる可能性があります[23]。ただし、タンパク質コロナが細胞毒性を増加または減少させるかどうかに関して物議を醸す報告があります。したがって、PV-AuNPの細胞毒性はFBSの存在下と非存在下で評価されました。 FBSがない場合、HT-29は3つのセルの中でテストされた濃度(29.9〜478.3μg / mL)で最大の細胞毒性を示し(図9a)、次にMDA-MB-231(図9b)、最後にPANCが続きました。 -1(図9c)。ただし、FBSの存在下では、これらのセルは異なる現象を示しました。 PANC-1が最も高い細胞毒性を示し、次にHT-29細胞が続きました。 FBSがなく、478.3μg/ mLのAuがある場合、PANC-1細胞とMDA-MB-231細胞の両方で有意な細胞毒性は見られませんでしたが、HT-29細胞では強い細胞毒性が観察されました(65.6%の細胞毒性)。ただし、FBSの存在下では、478.3μg/ mLのAuでPANC-1の細胞毒性(37.5%の細胞毒性)が観察されました。一般に、タンパク質コロナに囲まれたPV-AuNPは、組織特異的な結果でしたが、癌細胞に対する細胞毒性に強く影響しました。 FBSによって生成されたタンパク質コロナは、FBSの非存在下での細胞毒性と比較した場合、PANC-1に対する細胞毒性を増加させました。ただし、HT-29のタンパク質コロナの存在下では、タンパク質コロナなしの細胞毒性と比較して、細胞毒性が低下しました。
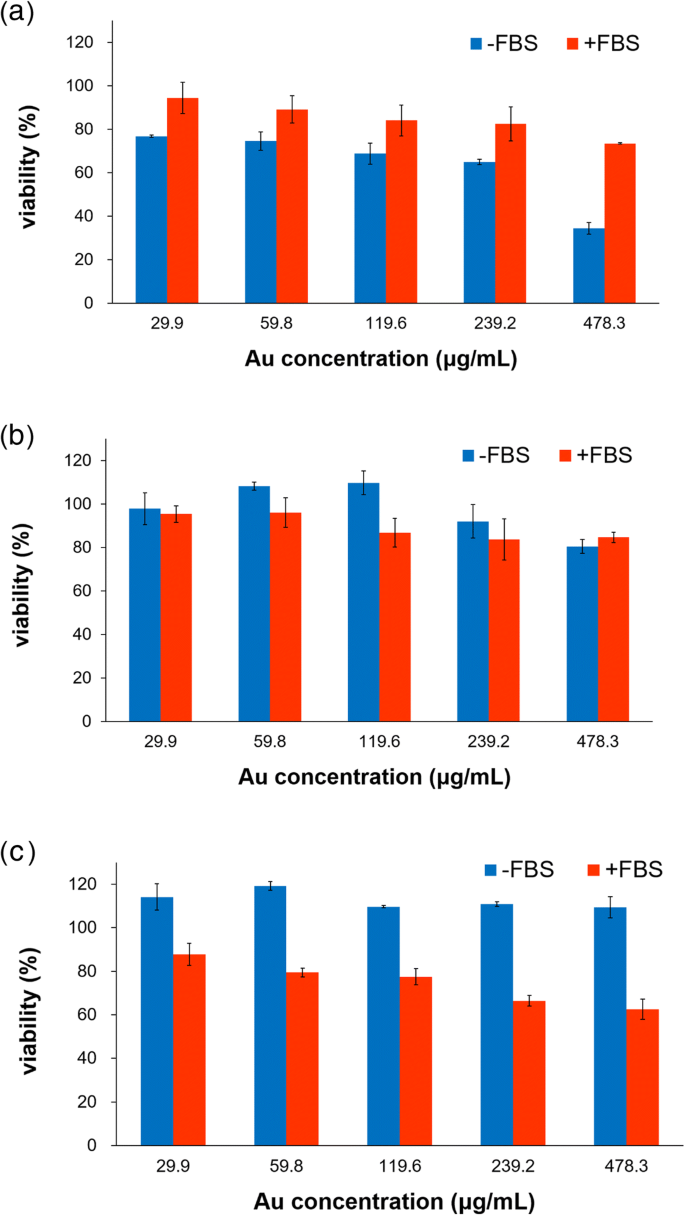
癌細胞に対するinvitro細胞毒性。 a HT-29。 b MDA-MB-231。 c PANC-1
さまざまなタンパク質が正電荷と負電荷の両方のAuNPに結合することが報告されていますが、中性電荷でAuNPに結合するタンパク質はほとんどありません[17、24]。負に帯電したAuNPは、正に帯電したAuNPよりも高い親和性とフィブリノーゲンタンパク質の放出が遅いことを示し、負に帯電したAuNP上にフィブリノーゲンの特異的結合部位が存在することを示唆しています[17]。 PV-AuNPは負のゼータ電位を持っていました。したがって、フィブリノーゲンの結合は、癌細胞に対する細胞毒性に影響を与える可能性があります。ナノ粒子のタンパク質コロナの調査は、将来の生物医学および臨床応用のためのナノ医療研究に有益です。
結論
Aの水性抽出物。キャピラリス 、 P。オレラセア 、および P。尋常性 フリーラジカル捕捉活性、総フェノール含有量、および還元力によって評価された抗酸化活性を示した。 P。尋常性 最高の抗酸化活性を発揮し、次に Aが続きました。キャピラリス および P。オレラセア 。 Pの抽出物。尋常性 最高の抗酸化活性を持っていたのは、AuNPのバイオファブリケーションのための非常に効率的なグリーン還元剤でした。私たちの研究の結果は、フリーラジカル捕捉活性、還元力、総フェノール含有量などの抗酸化活性の要因が、コロイド溶液の色と結果のSPRバンドの形状と密接に関連していることを示していますAuNPs。抗酸化活性が高い場合、得られたAuNPは強い吸光度を持つ狭いSPRバンドを示しました。対照的に、PO-AuNPでは広いSPRバンドが観察され、 P。オレラセア 3つの抽出物の中で最も低い抗酸化活性を示しました。さらに、PO-AuNPは、周囲温度での保管後に容易に凝集しました。したがって、 Pの抽出物。尋常性 最大SPRが530nmのさまざまな形状のPV-AuNPのワインレッドコロイド溶液を製造しました。 PV-AuNPsの面心立方結晶パターンは、高解像度X線回折分析によって確認されました。 ICP-OESによる反応収率は99.3%と推定されました。流体力学的サイズ(45±2 nm)はHR-TEM画像から測定されたものよりも大きく、植物化学物質がPV-AuNPの表面に結合していることを示唆しています。さらに、負の電荷を持つ植物化学物質は、おそらく-13.99mVの負のゼータ電位に起因します。 PV-AuNPの抗酸化活性は、DPPHラジカル捕捉活性に基づいて評価されたAu濃度に依存していました。高麗人参ベリーと Aを使用した緑色合成AuNP。 pubescens 根の抽出物もDPPHラジカル消去活性を示しました[20、21]。 PV-AuNPは、HT-29、PANC-1、およびMDA-MB-231細胞に対して細胞毒性を示しました。興味深いことに、FBSの有無は、これらの細胞に対する細胞毒性に劇的な影響を及ぼしました。この現象は、おそらくナノ粒子の表面を取り巻くタンパク質コロナが原因でした。
現在、AuNPは、ドラッグデリバリービヒクルまたはドキソルビシンなどの抗がん剤の担体として、ナノメディシンでさまざまな用途があります。 P。尋常性 酢酸エチル画分は、ドキソルビシン誘発性の酸化ストレスにさらされた単離されたラット心筋細胞に対して、濃度依存的に心臓保護効果を示しました[25]。 PV-AuNPは、心臓保護能力を備えたドキソルビシンデリバリービヒクルとして適用できます。したがって、私たちのその後の作業では、将来の生物医学および製薬用途のために、ドキソルビシンをロードしたPV-AuNPの抗癌活性を調査します。多様な植物抽出物は、AuNPをバイオファブリケーションするための効果的な還元剤になる可能性があります。バイオファブリケーション反応を行う場合、安定したAuNPを生成するためには、抗酸化作用の高い植物抽出物を選択することが不可欠です。さらに、 P。尋常性 抽出物は、将来的に価値のある用途を持つ他の新規金属ナノ粒子のグリーン合成のための還元剤として使用される可能性があります。
略語
- ABTS:
-
2,2'-アジノ-ビス(3-エチルベンゾチアゾリン-6-スルホン酸)
- AC-AuNPs:
-
Aの抽出物によって合成された金ナノ粒子グリーン。キャピラリス
- AgNPs:
-
銀ナノ粒子
- AuNPs:
-
金ナノ粒子
- BHT:
-
ブチル化ヒドロキシトルエン
- DMEM:
-
ダルベッコの改良イーグル培地
- DPPH:
-
2,2-ジフェニル-1-ピクリルヒドラジル
- FBS:
-
ウシ胎児血清
- GAE:
-
没食子酸当量
- HR-TEM:
-
高分解能透過型電子顕微鏡
- HR-XRD:
-
高解像度X線回折
- HT-29:
-
ヒト結腸直腸腺癌細胞
- IC 50 :
-
最大阻害濃度の半分
- ICP-OES:
-
誘導結合プラズマ発光分光法
- MDA-MB-231:
-
ヒト乳房腺癌細胞
- PANC-1:
-
ヒト膵臓腺管腺癌細胞
- PO-AuNPs:
-
Pの抽出物によって合成された金ナノ粒子グリーン。オレラセア
- PV-AuNPs:
-
Pの抽出物によって合成された金ナノ粒子グリーン。尋常性
- SPR:
-
表面プラズモン共鳴
- WSTアッセイ:
-
水溶性テトラゾリウムアッセイ
ナノマテリアル
- プラズモンナノ粒子
- 化学療法センサー用の金ナノ粒子
- 改善された診断および治療用途のための多機能金ナノ粒子:レビュー
- 癌治療のためのナノ粒子:現在の進歩と課題
- Escherichia coliに対する酸化銅ナノ粒子の生体合成、特性評価、および抗菌力の評価
- マウスにおける二酸化チタンナノ粒子の潜在的な肝臓、脳、および胚の毒性
- In VivoCTイメージングおよび腎クリアランス特性のための新しい生体適合性AuNanostars @PEGナノ粒子
- 炭化水素中の金ナノ粒子のサイズ制御と安定化のための分散剤としての修飾ハイパーブランチポリグリセロール
- 光熱治療および光音響イメージングのためのポリピロール被覆鉄-白金ナノ粒子の合成およびinvitro性能
- 生物医学的応用のための球形の共役金-ザルガイ殻由来炭酸カルシウムナノ粒子の製造、特性評価および細胞毒性
- 6-メルカプトプリンとニューロン透過性ペプチドで修飾された金ナノ粒子によるSH-SY5Y細胞増殖の促進



