NIR-II光熱治療用のBSAコーティングされた金ナノロッド
要約
2番目の近赤外線ウィンドウは、深部組織への浸透能力があるため、医用画像および治療に最適な光学ウィンドウであると考えられています。長波長吸収と低細胞毒性を備えた金ナノロッドの調製は、依然として課題です。アスペクト比の大きい一連の金ナノロッドを合成しました。 1000〜1300nmの2番目の近赤外線ウィンドウで強いプラズマ吸収が観察されました。合成された金ナノロッドの生体適合性は、ウシ血清アルブミン(BSA)によるコーティングによって劇的に改善されますが、その光学特性は維持されます。乳がんの担癌マウスは、NIR-IIの光強度が0.75 W / cm 2 と低い、準備された金ナノロッドで十分に治療できます。 。要約すると、これらの結果は、大きなアスペクト比のグールドナノ粒子を介してNIR-II領域の腫瘍を治療するために低照明線量を使用することの実現可能性を示しています。
はじめに
金ナノ粒子は、優れた生体適合性と低い細胞毒性として、生物医学研究で幅広い関心を集めています。たとえば、X線減衰効率の高い金ナノ粒子は、コンピューター断層撮影(CT)ベースの腫瘍診断に有望であることがわかりました[1、2]。さらに、金ナノ粒子は、表面プラズモン共鳴(SPR)効果として知られる優れた光学特性を示します。金ナノ粒子は、表面プラズモン共鳴光の存在下で、癌治療のために光子エネルギーを熱エネルギーに効率的に変換することができます[3、4]。したがって、調整可能なサイズと形態を備えたさまざまな金ナノ粒子が、腫瘍の光熱焼灼のために開発されてきました。たとえば、金ナノロッド、金ナノシェル、金ナノケージなどです[5、6、7]。特に、異方性の形状とサイズを調整できる金ナノロッド(AuNR)は、その優れた光熱安定性、生体適合性、およびNIR領域での強い吸収により、広く研究されてきました[8]。光の波長が長いほど光散乱損失が低くなるため、近赤外光が可視光よりも効果的に生体組織に浸透する可能性があることはよく知られています[9]。さらに、棒状のナノ粒子は、腫瘍の透過性が劇的に向上し、血液循環時間が長くなり、腫瘍の蓄積が増えることがわかっています[10、11]。しかし、金ナノロッドを光熱治療(PTT)に適用することの重大な欠点は、高出力レーザー照射であり、これは正常組織に大きな損傷を与える(最大許容光強度曝露)[12]。 2番目の近赤外ウィンドウ(NIR-II、1000〜1700 nm)のPTTは、NIR-I(700〜1000 nm)のPTTよりもはるかに深い組織侵入深さを持ち、NIRでの光散乱がはるかに少ないことが証明されています。 -II [13,14,15,16,17]。したがって、NIR-IIのPTTナノプラットフォームは、腫瘍のより効果的なPTT治療を達成し、より複雑な腫瘍治療のための大きな臨床応用の可能性を秘めていると期待されています。しかし、長波長吸収と低細胞毒性を備えた金ナノロッドの調製は、依然として大きな課題です。ここでは、近赤外ウィンドウ(1000〜1300 nm)の2番目のウィンドウに吸収ピークを持つ種なし法による金ナノロッドの合成について報告します。細胞毒性を低減するために、BSAでコーティングすることにより表面修飾が導入されました。準備された金ナノロッド(AuNR @ BSA)のアスペクト比は、透過型電子顕微鏡(TEM)と動的光散乱(DLS)によって特徴づけられました。乳がん腫瘍を有するマウスモデルを使用して、AuNR @BSAの光熱治療効果をテストしました。腫瘍は、0.75 w / cm 2 という低い光強度で十分に治療できることがわかりました。 。
材料と方法
資料
塩化金三水和物(HAuCl 4 ・3H 2 O)(99.9%)、ヘキサデシルトリメチルアンモニウムブロミド(CTAB)(99%)、硝酸(GR、65–68%)、および過酸化水素水(GR、30%)は、Shanghai Aladdin biotechnology Co.Ltdから入手しました。 。臭化アンモニウムナトリウム(NaBH 4 )(97%)および硝酸銀(AgNO 3 )(99.8%)はShanghai Lingfeng Chemical Reagent Co. Ltdから受け取りました。塩酸(HCl)(38%)はDongguan Dongjiang Chemical Reagent Co. Ltdから受け取りました。Hydroquinone(99%)はEnergyChemicalから受け取りました。ウシ血清アルブミン(98%)はSigma-Aldrichから入手しました。水酸化ナトリウム(AR、96%)はGreagentから受け取りました。
RPMI 1640培地およびペニシリン-ストレプトマイシンは、HyCloneから購入しました。リン酸緩衝液(PBS)はCorningから購入しました。パンクレアチンはクーラバーから購入しました。ウシ胎児血清(FBS)はGibcoから購入しました。 4T1細胞は、中国科学アカデミーの深セン先端技術研究所の生物医学光学および分子イメージング研究センターから提供されました。 Dojindo Chemical Technology(Shanghai)Co.、Ltdは、細胞増殖および毒性試験用のCell Counting Kit-8(CCK-8)を提供しました。実験全体を通して、ミリポアの超純水を使用しました。
AuNR @CTABナノ粒子の調製
金ナノロッドの合成は次のように行われます:0.4mLのHAuCl 4 (aq)(10 mM)および10 mLのCTAB(aq)(0.1 M)を23〜33 µLのAgNO 3 に添加しました。 (aq)(100 mM)。次に、10〜30 µLのHCl(1.2 M)と525 µLのハイドロキノン水溶液(0.1 M)を穏やかに混合しながら成長溶液に添加しました。成長溶液の色はオレンジ色から非常に明るい黄色に変わりました。 15分間攪拌した後、10〜40 µLの新たに調製した氷冷NaBH 4 (aq)(10 mM)溶液を成長溶液に注入しました。混合物を30秒間撹拌し、室温で18時間熟成させました。次に、AuNR @CTABをPBSで2回洗浄しました。
AuNR @BSAの準備
まず、一定量のCTABを追加してAuNR @CTAB溶液の濃度を1mMに調整し、次に超音波でCTABを完全に溶解します。 3mLのAuNR @ CTABを3mLのBSA溶液(10 mg / mL)にゆっくりと加え、混合溶液を30分間超音波処理します。 9500×rで40分間遠心分離した後、上澄みを6 mLのBSA溶液(5 mg / mL)に交換し、次に水酸化ナトリウム(2 M)でpHを11〜12に調整し、少なくとも18分間撹拌しました。 h。その後、合成されたAuNR @ BSAを9500×rで40分間遠心分離し、PBSで2回洗浄し、さらに使用するためにPBSに溶解しました。
AuNR @CTABおよびAuNR @ BSAナノ粒子の特性評価
金ナノロッドの形態解析は、Beijing Zhongke Baice Co.、Ltd。がTalosF200X電子顕微鏡を介してTEM画像を取得するために取得しました。 Zetasizer Nano ZS(Malvern、UK)を使用して、DLSによるさまざまなナノ粒子のサイズ分布とゼータ電位を研究しました。 UV-Vis吸収スペクトルは、UV-2700紫外可視分光光度計(島津製作所、日本)によって決定されました。
腫瘍内のAuNR @ BSAの形態特性評価のために、100 µLのAuNR @ BSA(1064nmでOD =25)を約10分間照射して腫瘍部位に注入し、その後、治療した腫瘍を収集しました。未治療の腫瘍を対照として収集した。収集された腫瘍は、透過型電子顕微鏡法(Beijing Zhongke Baice Co.、Ltd)のために、2.5%グルタルアルデヒド溶液(Coolaber.co。、北京、中国)でインキュベートされました。 AuNRサンプルのフーリエ変換赤外分光法(FT-IR)パターンとX線回折(XRD)パターンは、Beijing Zhongke Baice Co.、Ltd。によって取得されました。
AuNR @CTABおよびAuNR @ BSAの光熱性能の測定
金ナノロッド溶液を1064nm(0.5、1、1.5、および2)で異なるODに希釈し、PBSをブランクコントロールとして使用しました。金ナノロッド(500 µL)に1064 nmレーザー(Haoliangtech、上海、中国)を0.35–1 W / cm 2 の出力強度で照射しました。 30分間。温度は赤外線サーマルイメージャー(FLUKE TI25)で記録されました。
AuNR @BSAの光安定性
光安定性をテストするために、AuNR @BSAの吸収スペクトルを照射時間の関数として測定しました。 AuNR @ BSA(OD =1)をNIRレーザー(1064 nm、0.5 w / cm 2 )で照射しました。 )。 0〜10分の間、スペクトルは1分ごとに記録されました。光熱サイクルテストは、AuNR @ BSA溶液(0.5 mL)に10分ごとのレーザー照射のオンとオフ(1064 nm、0.5 W / cm 2 )を照射して実施しました。 )、温度変化を記録しました。
細胞培養
マウス乳がん細胞株(4T1細胞)は、10%FBSと100 U / mLペニシリンまたは100µg / mLストレプトマイシンを含むRPMI1640で培養しました。培養環境は37℃、加湿条件は5%CO 2 。
インビトロ金ナノ粒子の細胞毒性評価
CCK-8アッセイは、金ナノロッドの細胞毒性を特定するために使用されました。 4T1細胞を96ウェルプレートに事前に播種しました(5×10 3 ウェルあたり)、24時間インキュベートします。続いて、10μLのさまざまな濃度のAuNR @CTABおよびAuNR @ BSAを添加し、さらに24時間インキュベートしました。 PBSで2回洗浄した後、10μlのCCK-8溶液を各ウェルに加え、40分間インキュベートした後、マイクロプレートリーダーで450nmの吸光度を測定しました。
光毒性については、4T1細胞を96ウェルプレートに事前に播種しました(5×10 3 ウェルあたり)、24時間インキュベートした後、細胞にNIRレーザー(1064 nm、0.75 W / cm 2 )を照射しました。 、10分)、さらに24時間インキュベートします。その後、10μLのCCK-8溶液を各ウェルに加え、37℃でさらに40分間インキュベートしました。次に、マイクロプレートリーダーを使用して、450nmでの各ウェルの吸光度を検出しました。
腫瘍を抱えるマウスモデル
すべてのBALB / cマウスは、Beijing Vital River Laboratory Animal Technology Co. Ltdから購入しました。すべての動物実験手順は、中国科学院の深セン先端技術研究所委員会によって承認された標準手順に従って実行されました。腫瘍モデルは、4T1細胞を皮下注射することによって確立されました(2×10 6 )マウスの背中に。腫瘍体積が約100mm 3 に達したときに、動物実験を実施しました。 。
In Vivo 血液循環と生体内分布
循環時間の測定では、最初に200μLのAuNR @BSAをBALB / cマウスの尾静脈に静脈内注射し、次に20μLの血液を0.25、2、4、6、8、12、36、および48時間、30μLのPBSで希釈して、50μLの血液サンプルを取得します。約400μLの濃縮HNO 3 (クロマトグラフィーグレード)を追加し、蓋を締めて90°Cで2時間分解しました。室温まで冷却した後、150μLのH 2 O 2 (クロマトグラフィーグレード)をゆっくりと滴下し、カバーなしで1時間90°Cに加熱しました。最後に、溶液を超純水で5mLに希釈しました。 Auイオンの濃度は、0.44 mmナイロンシリンジフィルターを通過した後、誘導結合プラズマ発光分析(ICP-OES)によって測定されました。
生体内分布を測定するために、約200μLのAuNR @BSAをBALB / cマウスの尾静脈に静脈内注射しました。 24時間後、マウスを殺し、心臓、肝臓、脾臓、肺、腎臓を採取し、80°Cのオーブンで乾燥させました。消化する前に、各臓器の重さを量り、800μLの濃縮HNO 3 (GR)を加え、90°Cで2時間加熱しました。室温まで冷却した後、200μLのH 2 O 2 (GR)をゆっくりと滴下し、90°Cで1時間加熱した後、超純水で溶液を10mLに希釈しました。最後に、Auイオンの濃度は、0.44mmのナイロンシリンジフィルターを通過した後にICP-OESによって測定されました。
光熱処理効率
AuNR @ BSAの熱治療効果を評価するために、4T1腫瘍を有する担癌マウスをランダムに4つのグループに分け、腫瘍体積を約100 mm 3 :(1)AuNR @ BSA、(2)AuNR @ BSA +レーザー; (3)レーザーのみ(4)ブランクコントロール。赤外線熱画像装置を使用して、腫瘍部位の赤外線熱画像を記録した。マウスの腫瘍体積および体重は、それぞれ、治療の前後に記録された。腫瘍の体積は、通常の式(体積=幅 2 )に従って計算できます。 ×長さ/ 2)。 2週間後、マウスを殺し、腫瘍を分離しました。
データ分析
データ分析にはSPSS16.0統計ソフトウェアを使用しました。測定データは平均±dで表され、グループ間の比較は分散分析によって行われ、カウントデータの比較はカイ二乗検定によって行われました。 P <0.05は統計的に有意であると見なされました。
結果と考察
AuNR @CTABの合成と特性評価
金ナノロッドが小さいほど、薬物動態が良く、細胞毒性が低いことがわかりました[18]。ただし、金ナノロッドのSPR吸収ピークはアスペクト比との関連性が高く、アスペクト比が大きいほどSPRピークのエネルギーは低くなります。アスペクト比の大きいAuNRを合成する一方で、サイズをできるだけ小さくするために、界面活性剤濃度、成長溶液のpH、還元剤濃度などの合成パラメーターを最適化しました。 NaBH 4 (aq)は、LaMerバースト核形成とそれに続くAuイオンの急速なランダム付着および粒子内成熟を介してAu核を形成する一種の強力な還元剤です[19]。 NaBH 4 のモル量として 増加すると、金ナノロッドの最大吸収ピークは1223nmから865nmに青方偏移します(図1C)。成長溶液のpHも、塩酸の量によって調整される金ナノロッドの成長を制御するための重要なパラメーターです[20]。金ナノロッドの最大吸収ピークは、塩酸の量を増やしながら、871nmから1070nmに徐々に赤方偏移することがわかりました(図1D)。さらに、Ag + 金ナノロッドの成長方向を制御できると考えられており、Ag + 濃度を上げると、SPRピークのより長い吸収波長を実現できます(図1E)。最終的に、合成された金ナノロッドは、図1Bに示すように、ワインレッドになります。したがって、金ナノロッドの合成効率とレーザー光源の利用可能性を考慮して、腫瘍の光熱処理には1064nmに最大吸収ピークを持つ金ナノロッドを選択しました。
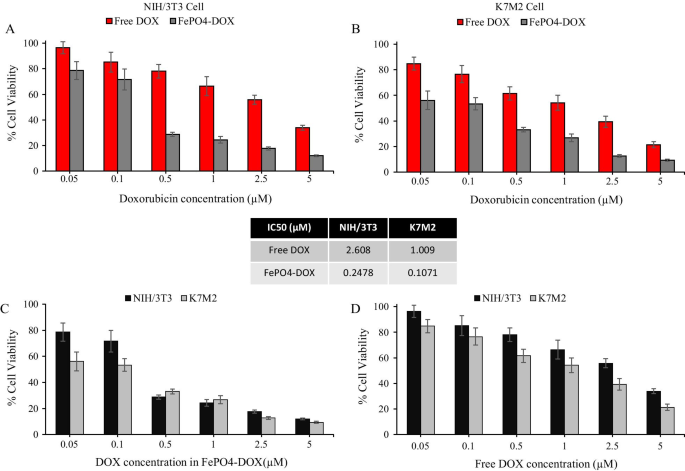
さまざまな合成条件でのAuNR @ CTABの光特性。 a AuNR @CTABの準備。 b CTABでコーティングされた金ナノロッド(AuNR @ CTAB)の画像、 c NaBH 4 を変化させて調製したAuNR @ CTABのUV-visスペクトル 濃度、 d HCl濃度を変化させて調製したAuNR @ CTABのUV-visスペクトル e AgNO 3 を変化させて調製したAuNR @ CTABのUV-visスペクトル 濃度
AuNR @BSAの合成と特性評価
セチルトリメチルアンモニウムブロミド(CTAB)は、正確な長さとアスペクト比を持つ金ナノロッドの合成に最も広く使用されている化合物です。ただし、濃度が1〜10μMを超えると、CTABは有意な細胞毒性を示します。生物医学におけるCTABコーティングされた金ナノロッド(AuNR @ CTAB)の適用は大幅に制限されています[21]。さらに、水溶液中のCTABコーティングされた金ナノロッドのコロイド安定性は、低温で結晶化しやすい温度の影響を大きく受けます[22]。 CTABの細胞毒性を低減し、その安定性を向上させることを考えると、金ナノロッド合成プロセス中にCTABを置き換えるか、CTABでコーティングされた金ナノロッドを機能化するためのいくつかのアプローチが提案されています。ポリマー、ペプチド、界面活性剤、脂質を使用してナノ粒子表面を修飾するこれらの戦略のほとんどは、チオール化分子または静電相互作用力を使用して金表面に結合します[23]。タンパク質は、コロイドの安定性、生体適合性、およびさらなる機能化の利点として、最も有望なオプションです。 [26]
CTABおよびBSAで包まれた金ナノロッドを図2Aに示します。 AuNR @BSAの最大吸収ピークは約1064nmであり、AuNR @CTABの吸収ピークと比較して約30nm赤方偏移しています(図2B)。金ナノロッドのゼータ電位は、CTABコーティングをBSAに置き換えることにより、正から負に変化しました(追加ファイル1:図S1)。 AuNR @BSAおよびAuNR @ CTABのFTIRスペクトル(追加ファイル1:図S2)から、1649 cm -1 に2つの特徴的なピークがあることがわかりました。 および1539cm -1 AuNR @ BSAの場合、BSAのアミドIおよびアミドIIの振動バンドに起因していました。動的光散乱(DLS)も、AuNR @CTABおよびAuNR @ BSAの流体力学的サイズを分析するために適用されました。さらに、AuNR @BSAとAuNR @ CTABの形態は、図2C、Dに示すように、透過型電子顕微鏡(TEM)によって特徴づけられました。DLSの散乱強度測定から2つのピークが明確に見つかりました。1つは流体力学的サイズが約3.10です( AuNR @ CTABの場合、±0.85)nmおよびその他の約57.45(±24.22)nm。ただし、AuNR @ BSAの場合、ピークは8.64(±3.80)nmおよび89.24(±42.24)nmにシフトします。端がわずかに丸くなることを除いて、BSAでコーティングした後もAuNRの形状は同じままであることがわかりました(図2C、D)。インビボ治療アプリケーションの場合、ナノ粒子の臨界サイズは100nm未満に制限されます[25]。このサイズを超えると、ナノ粒子が腫瘍に浸透する能力が制限されます。したがって、提示された金ナノロッドは理想的な腫瘍治療の候補となるでしょう[24]。追加ファイル1:図S3に示すように、Auナノ粒子の(111)、(200)、(220)、および(311)面から、XRDパターンでAuの特徴的なピークを明確に観察できます。
>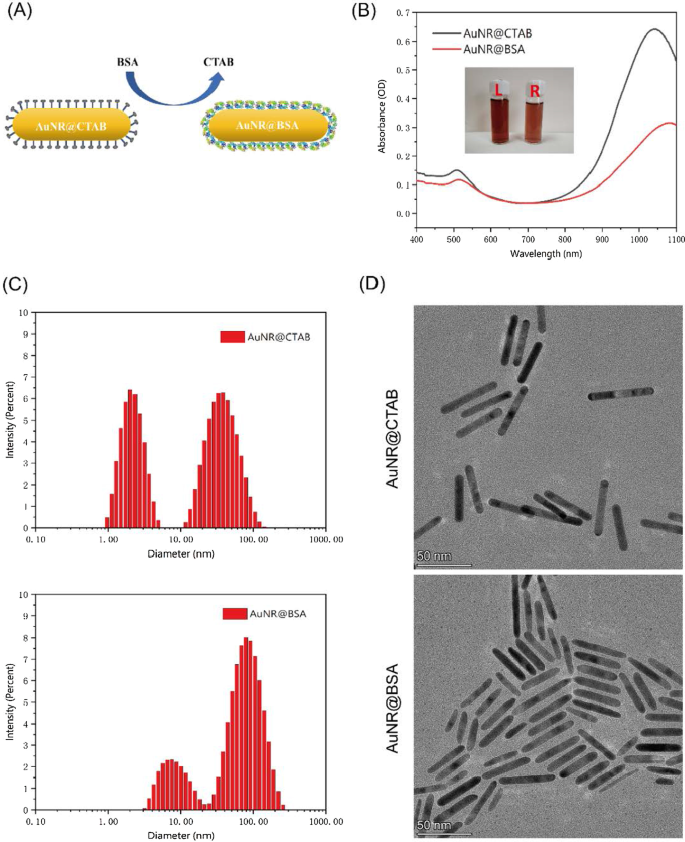
AuNR @BSAおよびAuNR @ CTABの特性評価。 a AuNR @BSAの準備。 b AuNR @ CTAB(L)およびAuNR @ BSA(R)のUV-Visスペクトル。 c AuNR @CTABおよびAuNR @ BSAのDLS強度測定。 d AuNR @CTABおよびAuNR @ BSAのTEM画像
インビトロ金ナノロッドの光熱効果
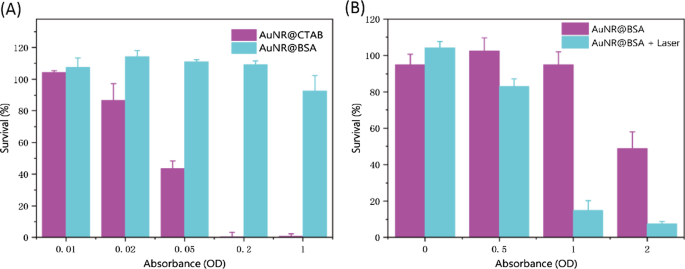
最も経済的なNIR-II光源としての1064nmダイオードレーザーは、光熱治療に最適な波長であると考えられています。したがって、効率的な光熱治療に理想的なNIR-II金ナノプラットフォームは、1064 nmでの強力なSPR吸収、高い光熱効率、および優れた光熱安定性として特徴付けられると考えられます。調製したAuNR @ BSAの光熱効果を調べるために、PBSとAuNR @ BSAのさまざまなOD(=0.5、1、1.5、2)を1064 nmで励起し、光強度を0.35〜1 W / cm 2 30分間。図3Aに示すように、温度イメージャを使用して5分ごとの温度変化を記録しました。同じ吸光度(OD =1)のAuNR @BSAとAuNR @ CTABの光熱効果は、PBSよりも大幅に高くなっています。図3Aに示すように、温度は最初の5分間で急速に上昇し、その後、残りの時間は約80°Cのままであることがわかりました。 PBSの光熱による温度上昇は、主に1064nmでの水の倍音吸収によって引き起こされます。光強度の関数としての最高温度を図3Bに示します。吸光度約1でのAuNR @ CTABおよびAuNR @ BSAの光誘起熱温度は光強度に比例することがわかりました。レーザー強度が高くなるにつれて、温度上昇はPBSよりもAuNR @CTABおよびAuNR @ BSAの方がはるかに速くなります。さらに、図3Cは、同じ照射条件(1064 nm、0.75 W / cm 2 )でのことを示しています。 )、両方のAuNRの吸光度が増加すると、最大光熱温度が劇的に上昇します。 BSAでコーティングされたAuNRの光熱特性は、CTABでコーティングされたものよりも少し優れています。 3回の照射サイクル(0.5 W / cm 2 )内で、AuNR @ BSAの最大光熱温度(OD =1、61.1°C)に大きな変化はありません。 、10分)。これは、準備されたAuNR @ BSAの優れた光熱安定性を示しています(図3D)。図3Eは、10分間のレーザー照射下でのAuNR @ CTAB(OD =1)、AuNR @ BSA(OD =1)、およびPBSの光熱温度画像を示しています。 PBSの最高温度は44.5°Cですが、AuNRの最高温度は85.5°Cです。上記の結果は、合成されたAuNR @ BSAが、優れた光熱治療剤として、適切な吸収特性、光熱変換効率、およびNIR-II範囲の光安定性を備えていることを示しています。
AuNR @BSAの光熱効果のinvitro評価。 a レーザー照射時間の関数としてのAuNR @ BSAおよびAuNR @ CTABの光熱温度(SPR吸光度約1、1064 nm、1 W / cm 2 )。 b レーザー照射強度(1064 nm、0.35〜1 W / cm 2 > )。 c 10分間のレーザー照射(1064 nm、1 W / cm 2 )で吸光度が異なるAuNR @BSAとAuNR @ CTABのNIRトリガー温度上昇 )。 d 3サイクルの照射(1064 nm、0.5 W / cm 2 )下でのAuNR @ BSA(OD =1)の光熱変換 )。 e NIRレーザー(1064 nm、1 W / cm 2 )を照射したPBS、AuNR @ CTAB(OD =1)、AuNR @ BSA(OD =1)の熱画像 )5分と10分の時間間隔で。 (平均±SD、n =3)
インビトロ金ナノロッドの細胞毒性と光熱毒性
CCK-8分析は、異なる濃度の4T1細胞に対するAuNR @CTABおよびAuNR @ BSAの細胞毒性を定量化するために実行されました。レーザー照射がなくても、AuNR @ CTABはすでに非常に低い濃度(吸光度約0.05)で有意な細胞毒性を示しているため、生物学的用途は大幅に制限されています。ただし、AuNR @ BSAは優れた生物学的応用の見通しを示しています。たとえば、AuNR @ BSAの吸光度が約1に達すると、細胞の生存率は依然として許容範囲内にあります(図4A)。 AuNR @ BSAの有望な安定性と高い光熱変換効率に後押しされて、光熱毒性はinvitroで4T1腫瘍細胞に対して約0.75W / cm 2 の光強度で実施されました。 10分間。有意な光熱毒性は、約20%の細胞生存率で約1の吸光度で見られました。ただし、非放射線実験では約100%の細胞生存率が見られました(図4B、追加ファイル1:図S4)。これらのinvitroの結果は、NIR-II領域でのAuNR @BSA光熱処理が比較的放射線強度で癌細胞を効果的に殺すことができることを示しています。
金ナノロッドのinvitro細胞毒性と光熱毒性。 a さまざまな濃度のAuNR @ CTABおよびAuNR @ BSAとインキュベートした4T1細胞の細胞生存率。 b NIRレーザー照射(1064 nm、0.75 W / cm 2 )の有無にかかわらず、さまざまな濃度のAuNR @BSAでインキュベートした4T1細胞の細胞生存率 、 10分)。 (平均±SD、n =3)
In Vivo 生体内分布研究
血液循環時間は、ナノ粒子ベースの薬物の送達を成功させるために不可欠です[24]。 AuNR @ BSAの血液循環時間は、ICP-OESを介してAu濃度によって監視され、約1.5時間(半減期)であることがわかりました(図5A)。 AuNR @BSAのinvivo生体内分布は、さまざまな臓器のAu濃度によっても測定されました(追加ファイル1:図S5)。図5Bに示すように、AuNR @ BSAは、細網内皮系(RES)の器官としての強い食作用により、24時間の静脈内注射後に肝臓と脾臓に高度に蓄積されました[27、28]。これらの結果は、AuNR @BSAが肝臓と脾臓に効果的に蓄積できることを示しています。 AuNR @ BSAは、肝臓および脾臓関連疾患に応用できる可能性があります。
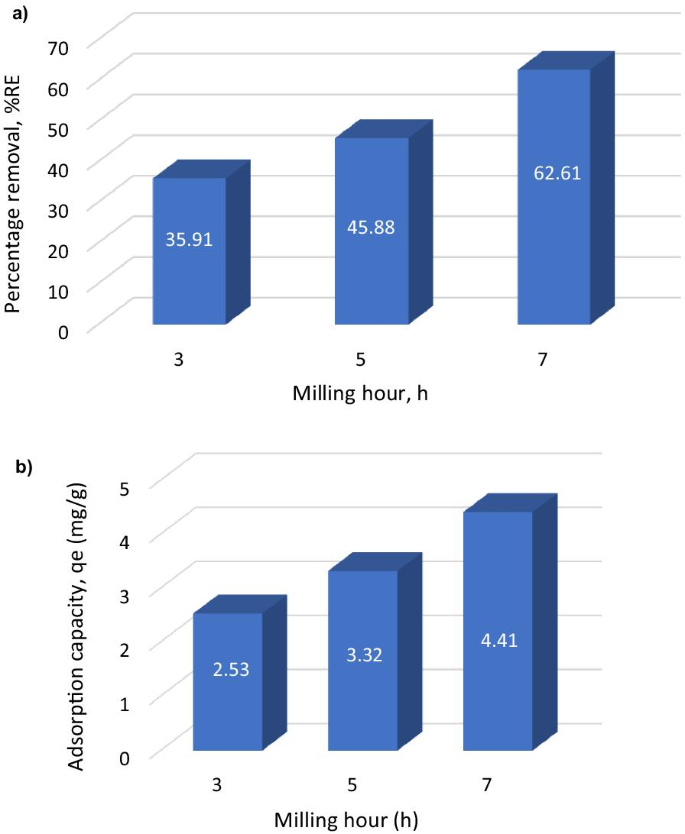
血液および臓器におけるAuNR @ BSAの生体内分布。 a AuNR @BSAの静脈内注射による時間の関数としての血中のAu濃度。 b さまざまな臓器におけるAuNR @ BSAの生体内分布
In Vivo 金ナノロッドの近赤外光熱処理
AuNR @ BSAの優れた光熱性能により、担癌BALB / cマウスのinvivo光熱療法を追求することができます。 AuNR @ BSAを腫瘍にその場で注入し、10分後に光熱治療のために光を導入しました(1064 nm、0.75 W / cm 2 )。インビボの温度変化は、熱温度イメージャーによって監視された。処理前後の温度変化を図6Dに示します。腫瘍部位の温度は、照射から10分以内に約63.9°Cであり、この温度ではほとんど変動しませんでした(図6D)。対照的に、同じ照射条件の対照群(AuNR @ BSA群、PBS群、レーザー群)では観察可能な温度変化はありません。光熱療法後、マウスの腫瘍体積と体重を2日ごとに14日間モニターしました。図6A、Bに示すように、AuNR @ BSA_laserグループの腫瘍は完全に抑制され、元の腫瘍部位の位置に火傷したかさぶたとして残されましたが、対照グループの腫瘍は比較的速く成長し、制御不能になりました(AuNR @ BSAグループ、 PBSグループ、レーザーグループ)。かさぶたは火傷した皮膚であり、これは、PPTプロセスがAuNR @BSAの注入により腫瘍部位に過剰な局所熱を引き起こす可能性があることを直接証明しています。 AuNR @ BSA +レーザーグループの固形腫瘍は治療の2日後に急速に減少することが観察されたため、光熱効果は非常に効率的です。治療後の腫瘍の変化をさらに把握するために、14日間の観察の終わりに、マウスを殺し、腫瘍を分離しました。図6Cに示すように、AuNR @ BSA_laser治療グループの腫瘍サイズは完全に抑制されましたが、他のすべてのグループは制御されていない成長であることがわかりました。グループ(AuNR @ BSA +レーザー)のマウスの画像は、14日間の治療後に腫瘍が成長し続けなかったことを示しました(図6E)。したがって、理想的な治療能力と明らかな細胞毒性がないことを考慮すると、近赤外セカンドウィンドウレーザー照射療法のAuNR @ BSAは、invivoでの光トリガーPTTの理想的な候補です。これは、現在のNR-II療法を使用した単純な温熱療法が、腫瘍の成長を効果的に抑制できることを明確に示しています(追加ファイル1)。
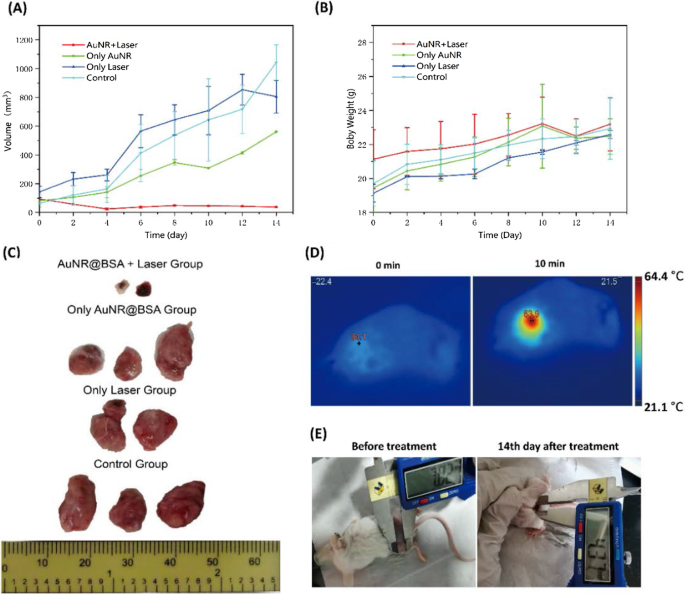
担癌マウスの光熱処理。 a 異なる治療条件下での時間の関数としての腫瘍体積。 b 治療後の時間の関数としての腫瘍を有するマウスの体重変化。 c 14日間の治療後のさまざまなグループの腫瘍組織の写真。 d 1064 nmレーザー(0.75 W / cm 2 )に曝露された担癌マウスの赤外線サーモグラフィー画像 、10分)AuNR @BSAの腫瘍内注射後10分。 e 治療後のAuNR @ BSA_laserグループのマウスの画像。 (平均±SD、n =2)
さらに、TEMは、光熱処理後の孤立した腫瘍と未治療の腫瘍に対して取得されました。 AuNRは、光熱処理後の腫瘍組織で観察できました。それは、金ナノロッドが腫瘍組織環境で依然として優れた光安定性を持っているというさらなる証拠を提供しました(図7)。
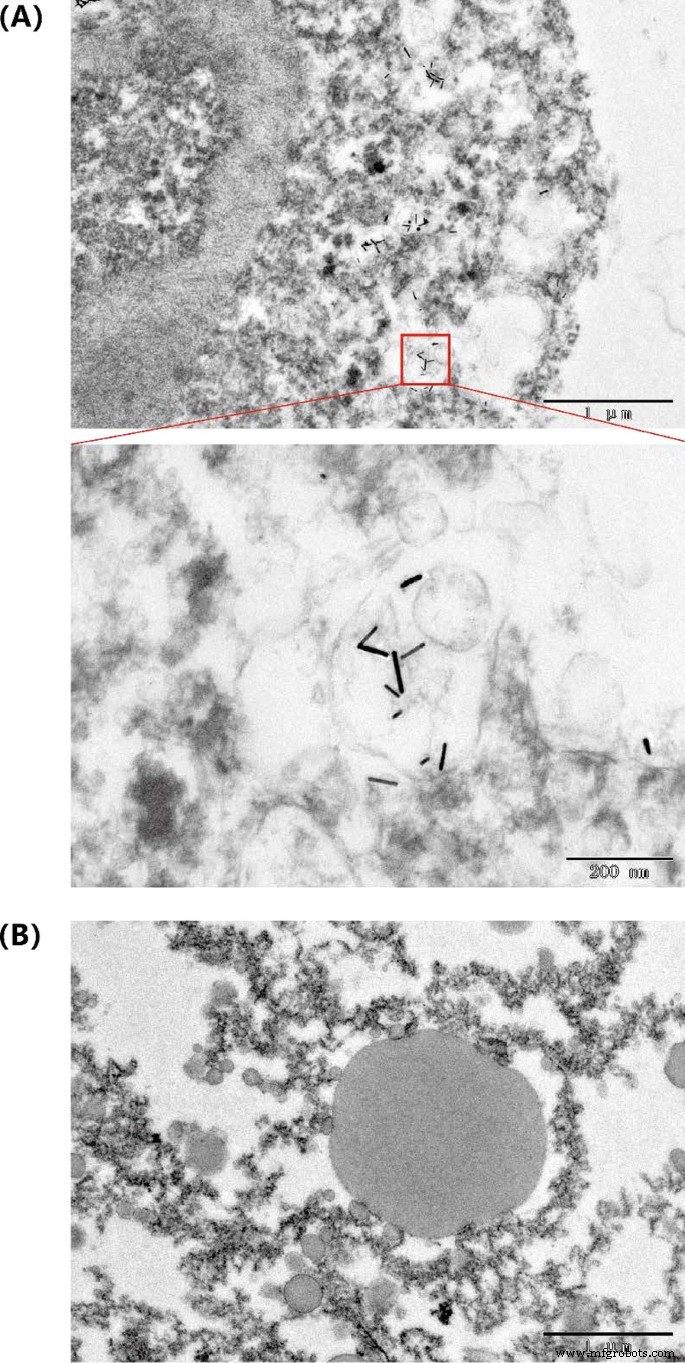
腫瘍組織におけるAuNR @ BSAの透過型電子顕微鏡写真 a 治療された腫瘍。 b 未治療の腫瘍
結論
ここでは、優れた光熱特性と生体適合性として、光熱治療の2番目の近赤外ウィンドウでSPR吸収が最大になるAuNR @BSAを合成しました。報告されたAuNRの生体適合性は、ウシ血清アルブミンでコーティングすることによって大幅に改善され、光熱特性は影響を受けませんでした。静脈内注射されたAuNR @ BSAの生体内分布は、大量のAuNRが肝臓と脾臓に蓄積したことを示しています。腫瘍内のAuNR @ BSAのTEM画像は、AuNRの高いin vivo光安定性を示しており、注射後、いくつかの光治療を適用して、望ましい治療結果を達成できる可能性があることを示唆しています。報告されたAuNRの優れた光熱変換は、低光照射下でも腫瘍の成長を十分に抑制することができました。免疫療法や化学療法などの他の治療戦略と組み合わせたAuNR @ BSAのPTTは、個別化された安全で効果的な腫瘍治療のための有用なツールを開発するために有望です。
データと資料の可用性
この研究で使用および/または分析されたデータセットは、合理的な要求に応じて対応する著者から入手できます。この調査中に生成または分析されたすべてのデータは、この公開された記事に含まれています。
ナノマテリアル
- プラズモンナノ粒子
- 化学療法センサー用の金ナノ粒子
- 受賞歴のあるセラピーボールに使用される医療グレードのTPE
- 改善された診断および治療用途のための多機能金ナノ粒子:レビュー
- 癌治療のためのナノ粒子:現在の進歩と課題
- 腫瘍治療のためのドラッグデリバリーシステムとしての環境応答性金属有機フレームワーク
- 光熱治療および光音響イメージングのためのポリピロール被覆鉄-白金ナノ粒子の合成およびinvitro性能
- 腫瘍の光検出および治療のための5-アミノレブリン酸-スクアレンナノアセンブリ:invitro研究
- 肥厚性瘢痕のinvitro経皮相乗光線力学/光熱療法のための生体適合性5-アミノレブリン酸/ Auナノ粒子負荷エトソーム小胞
- Cryptococcusneoformansの診断と光熱治療のための抗体結合シリカ修飾金ナノロッド:invitroでの実験
- 金を使用した量子技術のためのプラットフォーム



