ナノ硫化銅の調製と17α-エチニルエストラジオールに対するその吸着特性
要約
本研究では、管状のナノ硫化銅を水熱法で合成することに成功しました。準備された材料の物理的および化学的特性は、XRD、SEM、TEM、およびBETによって特徴づけられました。合成された硫化銅は、17α-エチニルエストラジオール(EE2)を除去するための吸着剤として使用され、優れた吸着特性を示しました。 25°Cで、15mgの吸着剤を50mLの5mg / L EE2溶液に適用し、180分後に吸着平衡に達し、吸着速度はほぼ90%に達しました。さらに、理論計算と実験結果に基づいて、吸着プロセスの速度論、等温吸着、および熱力学について議論しました。硫化銅の理論上の最大吸着容量は147.06mg / gと計算されました。この研究の結果は、硫化銅が安定した効率的な吸着剤であり、実用的な用途が有望であることを示しています。
はじめに
近年、社会産業の継続的な発展と成長に伴い、人間活動は環境に深刻な汚染を引き起こし、地球環境問題はますます深刻になっています。これらの中で、環境内分泌かく乱物質(EDC)は、ほとんどが残留性有機汚染物質(POP)であるため、生物蓄積性があり、毒性が高く、濃度が低く、潜伏している。それらは食物連鎖を介して直接的または間接的に人体に侵入することができ、生物で濃縮および増幅されました[1、2]。その結果、EDCのガバナンスに関する研究は、環境分野で広く懸念されるようになりました。多くの内分泌かく乱物質の中で、エストロゲンおよびビスフェノール化合物は生活の中で広く使用されており、その中で17α-エチニルエストラジオール(EE2)が典型的なものです。 EE2は、避妊薬やホルモン補充療法で一般的に使用されています。しかし、研究によると、EE2は生物や人間に深刻な害を及ぼし、生殖器系障害、不妊症、癌などの病気を引き起こす可能性があることが示されています[3,4,5,6,7]。水からのEE2は特に緊急です。
現在、EE2を除去する方法は、物理的方法(吸着と膜分離)、生分解法、化学的方法(酸化法と光触媒法)など、数多くあります[8,9,10,11]。これらの方法の中で、吸着法は、その低コスト、単純さ、および二次汚染がないため、有望な用途があります。これまで、研究者はEE2を吸着するためにバイオチャコール、活性炭、カーボンナノチューブ、グラフェン、および粘土を使用してきました[12、13、14]が、全体的な吸着効果は低く、時間がかかります。ユンら水中で100nmol / Lの濃度のEE2を吸着するために活性炭を使用しました。活性炭の投与量が9mg / Lの場合、EE2を完全に吸着するのに24時間かかりました[8]。
硫化銅は重要な遷移金属硫化物であり、水に溶解するのが非常に難しく、最も不溶性の物質の1つです[15、16]。ナノ硫化銅は、その低コスト、簡単なステップ、形態の制御の容易さ、小さな粒子サイズ、大きな比表面積、および高い光熱変換率のために、光伝導性材料として広く使用されています。また、光触媒、熱電対、フィルター、太陽電池、生物医学にも応用できる可能性があります[17]。アルカリ性環境では、硫化銅の等電点(IEP)が大きく、その表面は正電荷になりやすい[18,19,20]が、EE2の構造にはフェノール性ヒドロキシル基があります[21]。水溶液中で弱い酸性度と負の表面電荷を示す可能性があり、それらの間に強い化学吸着が生じます。したがって、硫化銅がEE2を吸着する可能性があります。
本研究では、水熱法により管状のナノ硫化銅を合成した。合成されたナノ硫化銅の比表面積は16.94m 2 でした。 / g、EE2の最大吸着容量は147.06 mg / gでした。調製したナノ硫化銅の結晶相組成、形態、比表面積を詳細に調べた。溶液のpH、吸着剤の量、吸着時間、吸着温度、およびEE2の初期濃度を最適化することにより、EE2への硫化銅の吸着特性を調べました。そして、EE2への硫化銅の動的吸着、等温吸着、および熱力学的吸着が実験データを通じて研究されました。
材料と方法
硫化銅吸着剤の合成
すべての化学試薬は分析グレードであり、さらに精製することなく使用されました。管状のナノ硫化銅は水熱法によって合成された。典型的な手順では、4.8ミリモルのCuCl 2 ・2H 2 Oおよび4.8mmolのCH 3 CSNH 2 を40mLの脱イオン水に溶解し、透明な溶液が形成されるまで磁気的に攪拌しました。次に、20mLの0.4mol / LのNaOH水溶液を上記の溶液にゆっくりと加えた。 5分間撹拌した後、混合溶液を100 mLのポリテトラフルオロエチレンで裏打ちしたステンレス鋼オートクレーブに移し、160℃で6時間加熱しました。続いて、オートクレーブを自然に室温まで冷却した。最後に、固体生成物を遠心分離し、エタノールと脱イオン水で交互に3回洗浄した後、60°Cで6時間乾燥させて材料を得ました。
特性評価
材料の結晶構造は、40kVおよび200mAのCuKα放射線を用いたTTRIIIX線回折計(リガク、日本)を使用したX線回折(XRD)によって特徴づけられました。材料の形態は、約20kVのQUANTA200走査型電子顕微鏡(SEM、FEI、米国)およびTecnai-G20透過型電子顕微鏡(TEM、FEI、米国)によって調査されました。ナノ硫化銅の表面積は、N 2 のBrunauer-Emmett-Tellerプロットを使用して取得されました。 吸着等温線。
吸着測定
吸着実験
50.00mLの特定の濃度のEE2溶液を含むヨウ素滴定ボトルに特定の量の吸着剤を添加しました。次に、ヨウ素滴定ボトルをシェーカーに入れました。一定の温度と200rpm / minの振とう速度で、混合溶液を一定時間振とうしました。次に、溶液を0.4 umの混合セルロースフィルターですばやくろ過して、溶液中の残留EE2の濃度を測定しました。
EE2濃度は、210 nmの検出波長で超高速液体クロマトグラフィー(UPLC、ウォーターズ、米国)によって検出されました。 C18カラム(1.7μm、2.1×50 mm)は、0.35 mL / minのアセトニトリル/水(55/45 v / v)、7μLの注入量で使用されています。
吸着モデル
吸着効率
吸着効率は、吸着剤によるEE2の除去率を示します。式は次のとおりです。
$$ \ mathrm {Absorption} \ left(\%\ right)=\ frac {C_0- {C} _e} {C_0} \ times 100 \%$$(1)C 0 および C e EE2の初期濃度(mg / L)と吸着平衡に達する濃度(mg / L)をそれぞれ表します。
吸着容量
平衡吸着量 q e は、吸着平衡に達したときの吸着剤の単位質量あたりの吸着質の量を示します。単位はmg / gで、計算式は次のとおりです。
$$ \ kern0.5em {q} _e =\ frac {\ left({C} _0- {C} _e \ right)V} {m} $$(2)V および m EE2の容量(mL)と吸着剤の投与量(mg)をそれぞれ表します。
吸着速度論
準一次反応速度モデルと準二次反応速度モデルを使用して実験データを線形に適合させることにより、硫化銅によるEE2の吸着の簡単な反応速度分析を行うことができます。準一次反応速度モデル[22]の式は次のとおりです。 (3):
$$ \ ln {q} _e =\ ln \ left({q} _e- {q} _t \ right)+ {K} _1t $$(3)q t は、時間 t でのEE2溶液を吸着する吸着剤の吸着量です。 、単位はmg / g、 K 1 は準一次速度論的吸着速度定数であり、単位はmin -1 です。 。準二次反応速度モデル[23]の方程式は次のとおりです。
$$ \ frac {t} {q_t} =\ frac {1} {K_2 {q} _e ^ 2} + \ frac {1} {q_e} t $$(4)K 2 は準二次吸着速度定数で、単位はg /(mg min)です。
等温吸着モデル
等温吸着モデルは通常、吸着プロセスにおける吸着剤と吸着質の相互作用を研究するために使用されます。 2つの一般的な等温吸着モデルがあります:Langmuirモデル[24]とFreundlichモデル[25]。
ラングミュアモデルは、吸着剤の表面の吸着サイトが均一に分布しており、吸着質が吸着剤の表面に単一の分子吸着層を形成することを前提としています。式の式は次のとおりです。
$$ \ frac {1} {q_e} =\ frac {1} {q_m {k} _L} \ \ frac {1} {C_e} + \ frac {1} {q_m} $$(5)q m EE2への吸着剤の最大吸着容量(または飽和吸着量)を表します。単位はmg / g、 k L はラングミュア定数で、吸着速度と脱着速度の比であり、吸着質への吸着剤の吸着強度を反映できます。単位はL / mgです。
Friendlies吸着モデルは、多層吸着モデルの研究に使用される実験式です。その表現は次のとおりです。
$$ \ ln {q} _e =\ ln {K} _F + \ frac {1} {n} \ ln {C} _e $$(6)K F は吸着剤の性能を特徴づけるために使用されるフロイントリッヒ定数であり、 n 吸着の難しさを反映しています。
吸着熱力学
吸着熱力学の研究は、EE2の除去に対する温度の影響を研究することによって実施されました。これにより、吸着プロセス中の内部関連のエネルギー変化をより深く理解することができました(図1)。吸着プロセスの熱力学的記述は、次の3つのパラメーターで構成されます。標準ギブズの自由エネルギー(Δ G θ )、標準の熱力学的エンタルピー(Δ H θ )、および標準の熱力学的エントロピー変化(Δ S θ )[26]。 3つの関係は次のとおりです。
$$ \ Delta {G} ^ {\ theta} =\ Delta {H} ^ {\ theta} -T \ Delta {S} ^ {\ theta} $$(7)<図> <画像> <ソースタイプ="image / webp" srcset ="// media.springernature.com / lw685 / springer-static / image / art%3A10.1186%2Fs11671-020-3274-6 / MediaObjects / 11671_2020_3274_Fig1_HTML.png?as =webp">
EE2の化学構造
上記の式のさらなる導出は、次のように表すことができます。
$$ \ Delta {G} ^ {\ theta} =-RT \ ln {K} _C $$(8)ここで R は気体定数で、値は8.314 J /(mol K)です。 T は吸着温度、単位は K ;および K C は熱力学的平衡定数です。計算式は次のとおりです。
$$ {K} _C =\ frac {C_0- {C} _e} {C_e} $$(9)要約すると、要約式を得ることができます:
$$ \ ln {K} _C =-\ frac {\ Delta {H} ^ {\ theta}} {RT} + \ frac {\ Delta {S} ^ {\ theta}} {R} $$(10)線形関数は、ln K をプロットすることで取得できます。 C 対−1 / T 。 Δ H の値 θ および∆ S θ フィットした線の傾きと切片から計算できます。
結果と考察
特性評価
XRD分析
材料の化学組成と相構造は、XRD技術を使用して研究されてきました。図2に示すように、2 θでの硫化銅の回折ピーク 28、30、32、33、43、53、および59°の値が観察されており、(101)、(102)、(103)、(006)、(110)、(108)、および(116)硫化銅の結晶面(JCPDS No. 06-0464)[27]。実験では、純相のナノ硫化銅が合成されたことが証明されました。他の回折ピークは観察されず、材料が高純度であることを示しています。
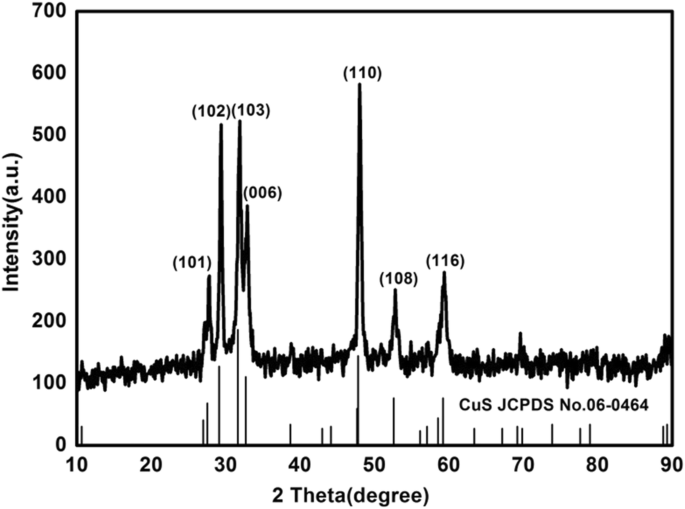
ナノ硫化銅のXRDパターン
SEM分析
走査型電子顕微鏡(SEM)を使用して、ナノ硫化銅の形態を研究しました。図3a、bは、さまざまな倍率での硫化銅のSEM画像を示しています。図3aは、低倍率で、硫化銅が長さ0.4〜8.8μm、幅0.1〜0.9μmの中空管状構造を持っていたことを示しています。図3bは、硫化銅の微視的形態を高倍率で示しています。図から、管状構造に粒子の堆積物があることがわかります。

ナノ硫化銅のSEM画像
TEM分析
図4は、ナノ硫化銅の透過型電子顕微鏡写真を示しています。図4aから、管状の硫化銅は比較的均一であり、管の直径は0.2〜0.7μmであることがわかりました。図4b、cから、合成管状硫化銅に加えて、粒子(球状)硫化銅が管状硫化銅上に堆積していることが明らかでした。これらの結果は、SEMの結果と一致していました。 SEMおよびTEM画像から、合成された硫化銅は管状と粒子(球形)の両方の形状をしていることがわかります。 2つの形状のうち、管状の硫化銅が主要部分を占め、粒子状(球状)の硫化銅は量が少なかったが、どちらの形状の硫化銅もEE2を吸着した。

硫化銅のTEM画像
BET分析
N 2 の向きと形状 吸着-脱着曲線を使用して、材料の細孔構造と細孔径分布を決定できます。 N 2 硫化銅材料の吸着-脱着曲線を図5に示します。Brunauer-Deming-Teller(BDDT)の吸着等温線分類[28]によると、これはタイプIV等温線に属していました。材料はメソポーラス構造でした。一般に、メソポーラス構造の存在は、活性種および反応物分子の吸着のためのより多くの表面活性部位を提供することができ、これは吸着特性に有益である。 BETテストの結果は、硫化銅の細孔径が18.16 nm、比表面積が16.94 m 2 であることを示しました。 / g、細孔容積は0.083 m 3 / g。このような構造と比表面積はEE2の吸着に有利でした。 SEMおよびTEM画像と組み合わせると、合成された硫化銅は管状と粒子(球形)の両方の形状を持っていることがわかります。したがって、硫化銅の両方の形状がBET測定に影響します。
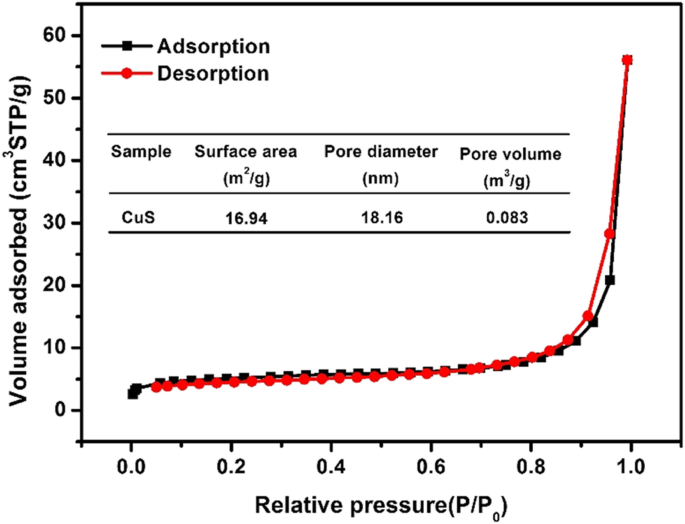
N 2 硫化銅の吸脱着曲線
吸着実験
吸着に対するpHの影響
EE2の吸着に対する溶液のpH値の影響を、NaOHおよびHClで溶液のpHを調整することによって研究した。 EE2吸着実験は、2.0〜10.0のpH範囲で、吸着剤の投与量10 mg、初期EE2濃度5 mg / L、シェーカー温度25°C、吸着時間3hで実施しました。図6に示すように、pHを2から6に上げたところ、硫化銅のEE2への吸着率はあまり変化せず、吸着率は約40〜45%でした。驚いたことに、pH値を8に変更すると、吸着率が急激に上昇し、77.1%に達しました。
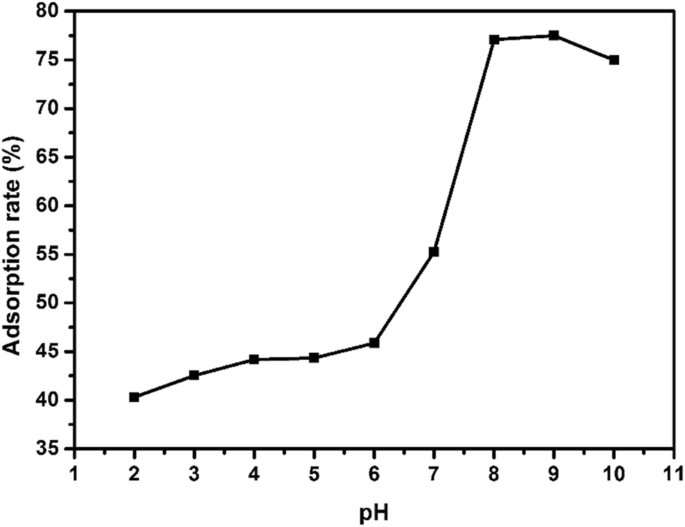
ナノ硫化銅によるEE2の吸着に対する異なるpHの影響
しかし、pHをさらに10に上げると、吸着率は74.9%に低下しました。 pHの変化に伴う吸着速度の違いの考えられる原因は、硫化銅の等電点(IEP)がアルカリ性環境で水酸化銅の等電点(IEP =9.5)にシフトしたことでした[16、17、18]。このとき、硫化銅の等電点(IEP)は比較的大きく、その表面は正電荷になりやすい[18,19,20]が、EE2の構造にはフェノール性ヒドロキシル基があった[21]。これは、水溶液中で弱い酸性度と負の表面電荷を示す可能性があり、それらの間に強い化学吸着を引き起こしました。溶液のpHが9.5を超えると、化学力が低下し、それに応じて吸着速度が低下しました。これは、実験データと一致していました。
実験データによると、以下の実験の最適pH値としてpH =8が選択されました。
吸着に対する吸着剤の投与量の影響
硫化銅によるEE2の吸着に対するさまざまな吸着剤投与量の影響を調査するために、さまざまな投与量の硫化銅(5 mg、7.5 mg、10 mg、12.5 mg、15 mg、17.5 mg、および20 mg)を使用してEE2を吸着します。 EE2吸着実験は、pH =8、初期EE2濃度5 mg / L、吸着温度25°C、時間3時間で実施しました。図7に示すように、吸着剤の投与量が5mgから20mgに増加すると、吸着率は54%から98%に増加しました。低線量では、吸着サイトが不十分なため吸着率が低く、吸着線量が増加すると吸着サイトが増加し、吸着率が増加しました。吸着量が15mgの場合、吸着率は90%近くに達し、吸着剤量20mgの場合の吸着率に非常に近い値でした。経済的および環境的問題を考慮して、15mgの吸着剤量が最適化された投与量として選択されました。
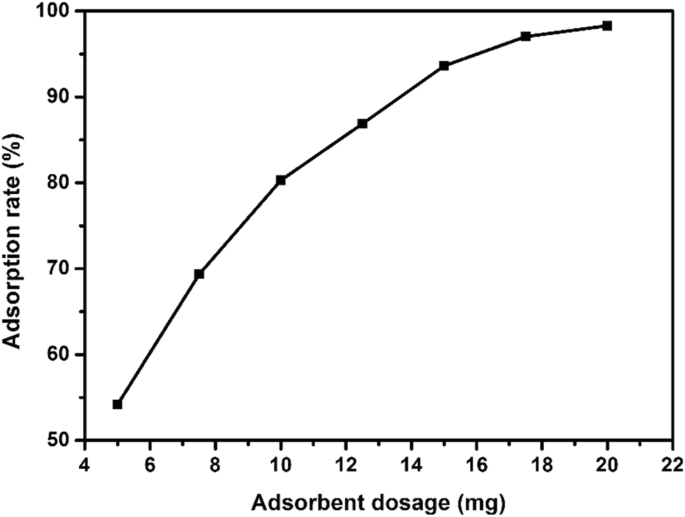
異なる硫化銅吸着剤の投与量が吸着に及ぼす影響
吸着時間の吸着への影響
硫化銅によるEE2の吸着速度に対する吸着時間の影響を調べるために、シェーカーの吸着時間を0、10、30、60、90、120、150、および180分に設定しました。 EE2吸着実験は、pH =8、吸着量15 mg、初期EE2濃度5 mg / L、吸着温度25°Cで実施しました。図8に示すように、硫化銅のEE2への吸着率は3時間の吸着後に89%に達しました。硫化銅とEE2の接触時間が長くなると、吸着除去率が高くなります。
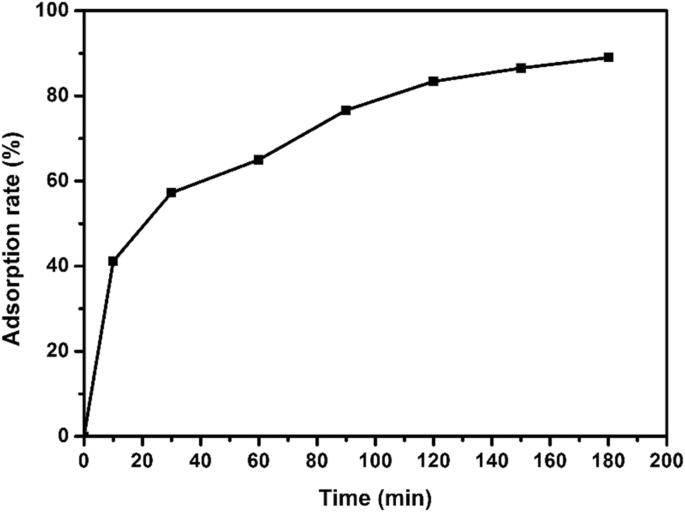
ナノ銅硫化物によるEE2の吸着速度の経時変化
吸着に対する温度の影響
硫化銅によるEE2の吸着に対する吸着温度の影響を検討するために、EE2吸着実験を25°C、35°C、および45°Cで実施しました。他の実験条件は次のように同じに保たれました:pHは8、吸着量は15 mg、初期EE2濃度は5 mg / L、吸着時間は3hでした。図9に示すように、温度が298から318 Kに上昇すると、吸着率は68.32から97.25%に増加しました。結果は、反応が吸熱反応であることを示しました。
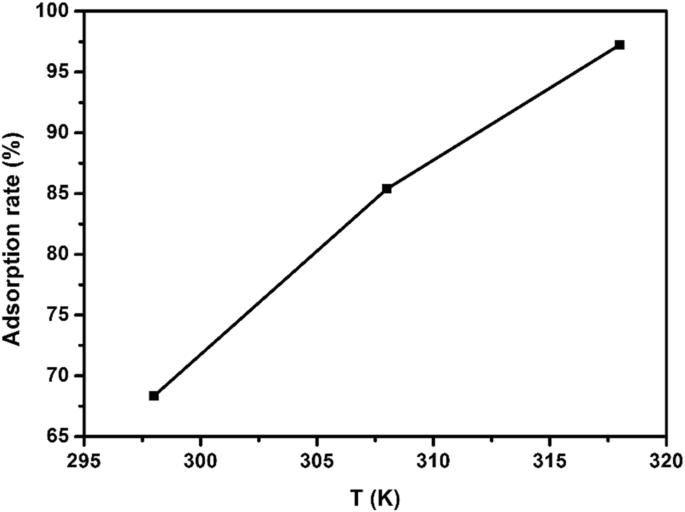
異なる温度と吸着速度の関係
EE2の初期濃度が吸着に及ぼす影響
図10は、EE2のさまざまな初期濃度(1、3、5、7、9 mg / L)と吸着剤の投与量15 mg、pH =8、25°C、吸着時間3の条件下での吸着速度のグラフです。 h。図から、EE2の初期濃度が1 mg / L、3 mg / L、5 mg / L、7 mg / L、9 mg / Lの場合、硫化銅のEE2への吸着除去率がわかります。 100%、100%、89.68%、78.69でした。それぞれ、%、68.32%。 EE2の初期濃度の増加に伴い、EE2への硫化銅の吸着除去率は徐々に低下しました。 EE2の初期濃度が3mg / Lを超えると、触媒の量が限られているためにEE2の吸着速度が低下し、高濃度のEE2に対して十分な活性部位を提供できなくなりました。
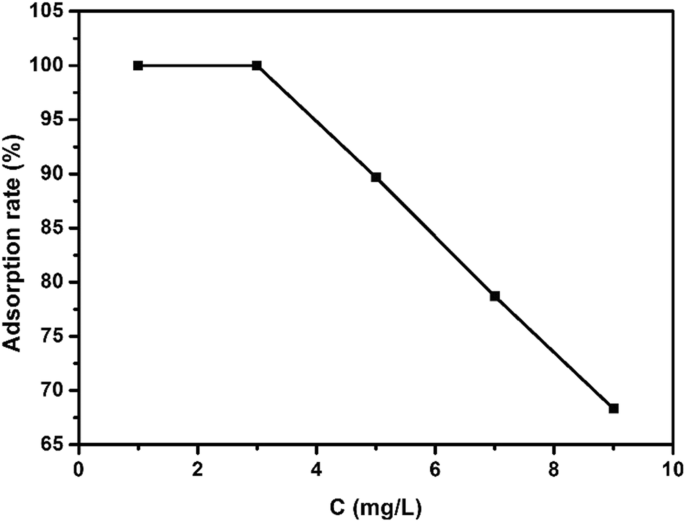
初期EE2濃度が吸着速度に及ぼす影響
吸着の安定性
合成されたナノ硫化銅の安定性を調べるために、硫化銅へのEE2の吸着のリサイクル実験を、初期EE2濃度5 mg / L、吸着剤量15 mg、pH 8、温度25°で実施しました。 C、および3hの吸着時間。吸着の各サイクルの後、吸着剤をEE2水溶液で遠心分離し、エタノールと水で6回交互に洗浄し、乾燥させて次のサイクルで再利用しました。図11aから、繰り返し回数が増えると吸着率はわずかに低下しましたが、それでも吸着率は85%を超えていることがわかります。図11bは、5サイクル前後の硫化銅のXRDパターンです。図から、サイクル前後の硫化銅の相組成がわずかに変化し、パターンのマークされた場所に2つの不純物ピークがあり、これがサイクル後の吸着率の低下の原因である可能性があります。 。図11c、dの硫化銅のSEMとTEMから、硫化銅の形態は5サイクル後も変化せず、管状および粒状(球形)の形状を示していることがわかります。
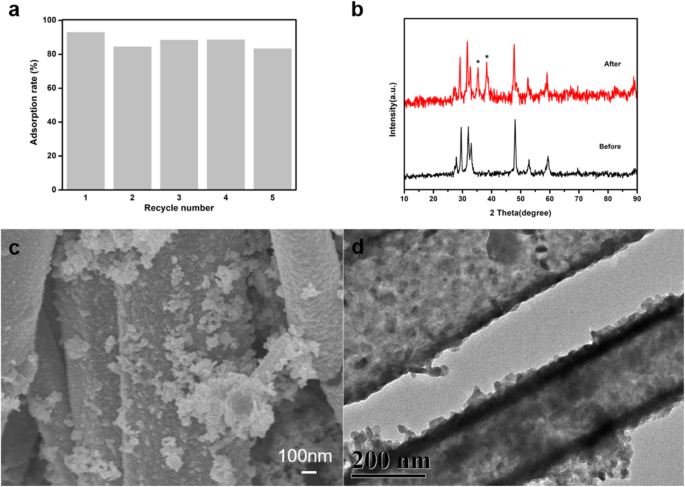
硫化銅吸着EE2の再現性実験( a ); CuSのXRDパターン、使用されたCuS( b );使用したCuSのSEM画像( c );使用済みCuSのTEM画像( d )
吸着メカニズム
運動実験
図12aは、硫化銅に吸着されたEE2の吸着量の経時変化を示しています。時間の経過とともに吸着量は徐々に増加しているが、変化の程度は徐々に減少していることがわかる。図12b、cは、硫化銅によるEE2の吸着の一次および二次速度論的適合を示しています。表1は、運動モデルの関連パラメータを示しています。一次反応速度方程式は、ln( q をプロットすることによって得られました。 e − q t )対 t 、および K 1 斜面でした。 2次反応速度方程式は、 t をプロットすることによって得られました。 / q t 対 t 、および K 2 切片によって計算できます。表1に示すように、 R 2 準一次反応速度のは0.9784でしたが、準二次反応速度モデルは R でした。 2 0.9916は、より良い線形関係を示します。したがって、硫化銅によるEE2の吸着は、疑似2次反応速度モデルによりよく適合します。さらに、理論的な平衡吸着量( q e 、cal )理論式と実験的に得られた吸着量( q e 、exp )、準二次速度論モデルにおけるそれらの値はより近かった。要約すると、硫化銅吸着EE2の手順は、準二次反応速度モデルに従いました。
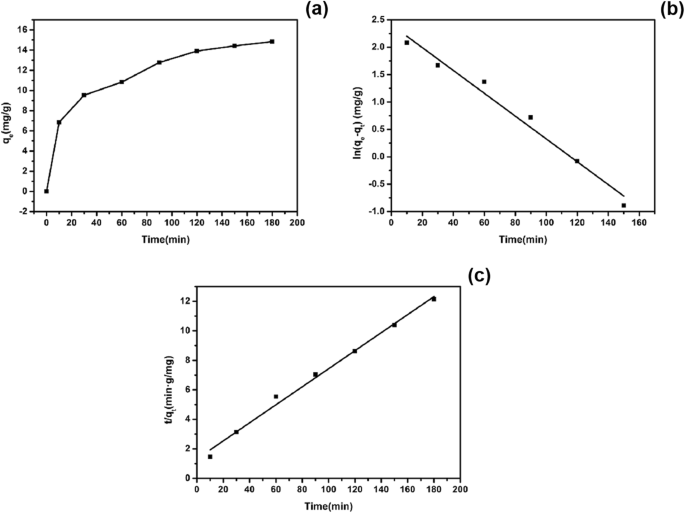
硫化銅の吸着の経時変化( a )、硫化銅吸着EE2の準一次速度論モデル( b )、および硫化銅吸着EE2の準二次速度論モデル( c )
等温吸着実験
図13aは、298 Kでの硫化銅の等温吸着曲線を示しています。この図から、EE2の濃度が高いほど、吸着量が多いことがわかります。図13b、cは、硫化銅によるEE2の吸着のLangmuirおよびFreundlich等温フィッティング曲線を示しています。表2は、LangmuirモデルとFreundlichモデルの関連パラメータを示しています。ラングミュアモデルは1 / q の線でプロットされました e 対1 / C e 、 q m 適合線の切片から取得でき、 K L 斜面でした。 Freundlichモデルは、ln C の線でプロットされました。 e 対ln q e 、 K F ラインインターセプトであり、1 / n 斜面でした。表2の関連パラメータから、ラングミュアモデルの線形相関係数が優れていることがわかります。これは、硫化銅によるEE2の吸着がラングミュアモデルとより一致しており、理論上の最大吸着量であることを示しています。 q m 硫化銅の量は147.06mg / gに達する可能性があります。
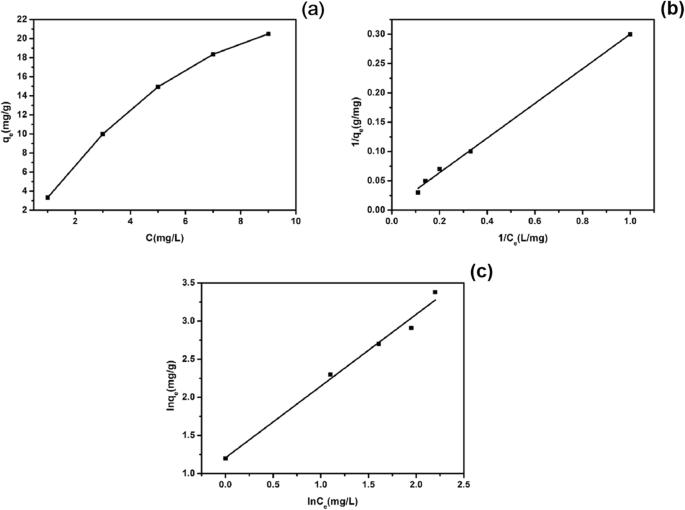
298 K硫化銅吸着EE2の等温曲線( a )、硫化銅吸着EE2のラングミュア等温線フィッティング( b )、および硫化銅に吸着したEE2のフロイントリッヒ等温線フィッティング( c )
熱力学的実験
図14に示すように、実験では、ln K によって線形フィットが実行されました。 C 〜1 / T 、および方程式ln K C =1268.1(− 1 / T )+ 43.37が得られ、∆ H θ はめあい線の傾きから得られ、∆ S θ インターセプトによって取得されました。次に、∆ G θ 298 K、308 K、および318 Kでの式を式(7)に従って計算し、実験結果を表3に示しました。表から、ギブズの自由エネルギー(∆ G > θ )硫化銅を吸着したEE2は負であり、熱力学的エンタルピー(∆ H θ )は正であり、エントロピー(∆ S θ )は正であり、吸着がエントロピーの増加を伴う自発的な吸熱プロセスであることを示しています。文献によると、Δ G の吸着プロセス θ − 20〜0 kJ / molは物理吸着ですが、∆ G θ − 400〜− 80 kJ / molは化学吸着プロセスです[29]。表3では、∆ G θ 熱力学的実験データに従って計算された値は、-1.84 kJ / mol(298 K)、-5.44 kJ / mol(308 K)、-9.04 kJ / mol(318 K)でした。したがって、硫化銅によるEE2の吸着は物理吸着に属していた。吸着プロセスでは、さまざまな吸着力によって引き起こされる吸着熱の絶対値は[30、31]でした:ファンデルワールス力の場合は4〜10 kJ / mol、疎水性相互作用力の場合は5 kJ / mol、2〜40 kJ /水素結合相互作用力の場合はmol、化学吸着相互作用力の場合は60 kJ / molを超えます。熱力学的エンタルピー(∆ H θ 実験から得られた=105.44 kJ / mol)は、EE2への硫化銅の吸着が化学的吸着特性を持っていることを示しました。表3から、∆ S θ > 0、EE2への硫化銅の吸着プロセスが溶液システムのカオスを増加させるプロセスであったことを示します。
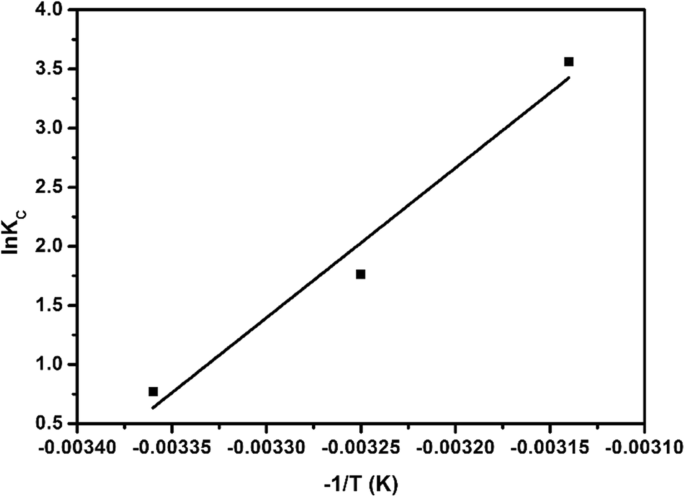
硫化銅吸着EE2の熱力学的適合
結論
本論文では、管状のナノ硫化銅を水熱法により合成した。合成された硫化銅は17α-エチニルエストラジオール(EE2)の吸着剤として使用され、優れた吸着特性を示しました。 25°Cで、15mgの吸着剤を50mLの5mg / L EE2溶液に適用しました。この溶液では、180分後に吸着平衡が達成され、吸着速度はほぼ90%に達しました。硫化銅材料の吸着メカニズムは、準二次反応速度モデルと一致していることがわかりました。等温吸着モデルはラングミュアモデルと一致し、硫化銅の最大理論吸着容量は最大174.06 mg / gでした。熱力学モデルの研究により、ギブズの自由エネルギー∆ G θ 硫化銅吸着のEE2は0未満であり、熱力学的エンタルピー∆ H θ は0より大きく、熱力学的エントロピー∆ S θ は0より大きく、吸着プロセス全体がエントロピーが増加した自発的な吸熱プロセスであることを示しています。熱力学的エンタルピー変化の値を調べることにより、∆ H θ 熱力学的エントロピーの変化∆ G θ 、吸着過程で化学的吸着と物理的吸着があることがわかった。さらに、合成されたナノ硫化銅吸着剤は、研究された条件下で非常に安定していた。ナノ銅硫化物吸着剤によってEE2を吸収することは実行可能で効率的です。
データと資料の可用性
この記事の結論を裏付けるすべてのデータが記事に含まれています。
略語
- BDDT:
-
ブルナウアー-デミング-テラー
- ベット:
-
Brunauer-Emmett-Tellerの測定値
- EDC:
-
環境内分泌かく乱物質
- EE2:
-
17α-エチニルエストラジオール
- IEP:
-
等電点
- POP:
-
残留性有機汚染物質
- SEM:
-
走査型電子顕微鏡
- TEM:
-
透過型電子顕微鏡
- UPLC:
-
超高速液体クロマトグラフィー
- XRD:
-
X線回折
ナノマテリアル
- アルミニウムのトップ10の特性とその用途
- アルミニウムの特性と合金の特性
- コバルトをドープしたFeMn2O4スピネルナノ粒子の調製と磁気特性
- TiO2ナノ流体に向けて—パート1:準備と特性
- ゾル-ゲル法によるナノ構造シリカ/金-セルロース結合アミノ-POSSハイブリッド複合材料とその特性
- SrTiO3修飾ルチルTiO2ナノファイバーのワンステップエレクトロスピニングルートとその光触媒特性
- In VivoCTイメージングおよび腎クリアランス特性のための新しい生体適合性AuNanostars @PEGナノ粒子
- Au @ TiO2卵黄シェルナノ構造の調製とメチレンブルーの分解および検出へのその応用
- パラジウム(II)イオンインプリント高分子ナノスフェアの調製と水溶液からのパラジウム(II)の除去
- 水溶性硫化アンチモン量子ドットの合成とそれらの光電特性
- 分子線エピタキシー法を用いたGeBi膜の作製と光学的性質



