金属および金属酸化物ナノ粒子のグリーン合成と単細胞藻類Chlamydomonasreinhardtiiに対するそれらの効果
要約
最近、金属ナノ粒子のグリーン合成は、その実現可能性と環境への影響が非常に少ないため、広く注目されています。このアプローチは、天然高分子カラヤゴムを還元剤として使用し、単純な水性媒体でナノスケールの金(Au)、白金(Pt)、パラジウム(Pd)、銀(Ag)、酸化銅(CuO)の材料を合成するためにこの研究に適用されました。安定剤。ナノ粒子(NP)のゼータ電位、安定性、およびサイズは、ゼータサイザーナノ、UV-Vis分光法、および電子顕微鏡法によって特徴づけられました。さらに、単細胞緑藻( Chlamydomonas reinhardtii )に対するNP(濃度範囲1.0〜20.0 mg / L)の生物学的効果 )は、藻類の成長、膜の完全性、酸化ストレス、クロロフィル( Chl )を評価することによって調査されました。 )蛍光および光化学系IIの光合成効率。得られたNPの平均サイズは42(Au)、12(Pt)、1.5(Pd)、5(Ag)、180(CuO)nmで、6か月間高い安定性を示しました。 5 mg / Lの濃度では、AuおよびPt NPは藻類の成長をわずかに減少させましたが、Pd、Ag、およびCuONPは成長を完全に抑制しました。 Ag、Pd、およびCuO NPは強力な殺生物特性を示し、スイミングプール(CuO)またはその他の抗菌用途(Pd、Ag)で藻類の防止に使用できますが、AuおよびPtはこれらの特性を欠いており、緑藻に無害であるとランク付けできます。 。
背景
金属および金属酸化物ナノ粒子(NP)は、その並外れた電気的、光学的、磁気的および触媒的特性により、かなりの研究の注目を集めています。これらは、さまざまな産業、医療、農業、および環境用途での幅広い使用を可能にし、さらに開発が続けられています[1,2,3,4]。自然のままの金属および金属酸化物NPの従来の合成方法には、人間およびさまざまな栄養段階の他の種に毒性のある化学物質の還元および安定化が含まれます[5、6、7、8、9、10、11]。これに応えて、研究者たちは現在、NPの製造中に有害な化学物質を削減または排除するための代替の「グリーン合成」アプローチを探しています[12、13、14、15、16、17、18]。
多くの研究が、その独特で広範囲の物理化学的特性のために、広範囲の金属および金属酸化物NPアプリケーションについて報告しています[19]。たとえば、銀(Ag)NPは、医療、繊維、食品包装、および水処理の用途に広く使用されています[20、21、22、23]。金(Au)NPは生物医学研究で使用されてきましたが、白金(Pt)NPは、その触媒特性により、産業用途で広く使用されています[24、25]。最後に、パラジウム(Pd)NPは、医薬品の製造時に触媒として使用され[26、27]、酸化銅(CuO)NPは、抗菌特性が証明されているため、塗料や布地の防汚剤として使用されています[28]。金属NPは、ポリ塩化ビフェニル(PCB)、ハロゲン化脂肪族、有機塩素系農薬、有毒金属、ハロゲン化有機溶媒など、さまざまな一般的な環境汚染物質を分解するための触媒として機能します[29]。 CuO、Ag、Au NPは、一酸化炭素(CO)、シアン化水素(HCN)、二酸化硫黄(SO 2 )などの有毒ガスの検知にも使用されます。 )[30、31]。最近、局在表面プラズモン共鳴を示す多くの金属NP(Au、Ag、およびCu)が、バイオナノセンサーの開発に使用されています[24]。
残念ながら、金属および金属酸化物NPは、人間の健康と環境一般の両方に悪影響を与える可能性があります。微生物群集に悪影響を及ぼし、生態系全体にノックオン効果をもたらす可能性のある新しいクラスの毒素を生成することによって[32、33、34、35]。その結果、微生物に対するNPの影響が広く研究されてきました。たとえば、Ag NPは、藻類の成長と光合成を阻害し、クロロフィル( Chl )を変化させることが示されています。 ) Chlamydomonas reinhardtii の蛍光含有量 [36]、 Thalassiosira pseudonana の細胞増殖を変化させる および Synechococcus sp。 [37]そして水生植物の腫れたアオウキクサ Lemna gibba の成長と細胞生存率に影響を与える [38] 。 Książyketal。 [39]およびSørensenetal。 [40]は、淡水微細藻類 Pseudokirchneriella subcapitata の成長を阻害するものとしてPtNPを報告しています。 [39、40]。当然のことながら、AgとPdの両方のNPは、さまざまなグラム陽性菌とグラム陰性菌に対する有用な抗菌剤として適用されてきました[41、42、43]。対照的に、Au NPはバクテリアや藻類に悪影響を及ぼさないと考えられていますが[44、45]、ある研究では、電荷と表面の化学的性質によっては有毒である可能性があることが示されています[46]。 CのCuONPに悪影響が報告されています。 reinhardtii [36、47]、 P。 subcapitata [48]、西部の水草 Elodea nuttallii [49]アオウキクサレムナ sp 。 、 Daphnia magna [48]およびゼブラフィッシュの初期のライフステージ Daniorerio [50、51]。
金属NPは、細胞の損傷を引き起こす可能性のある物理的および化学的特性を備えています。活性酸素種(ROS)の過剰な生成と、それに続くDNA、タンパク質、脂質への損傷を介して。 Ag NPによるROSの形成は、 Chlorella vulgaris で検出されました。 および Dunaliella tertiolecta 文化と L。ギバ [52]、およびバクテリア[53]。 CuOとFeNPはどちらも、フェントン反応によって生成されるROSのファミリーである水素ラジカルを生成することができます。これはさまざまな水生生物や陸生生物に害を及ぼす可能性があります[54、55]。
グリーンケミストリーは、有害物質の使用と生成を削減または排除する製品とプロセスの設計を促進する一連の原則または実践です[56、57、58]。現在のグリーンナノテクノロジーの実践には、多くの場合、天然資源、無害な溶媒、生分解性および生体適合性の材料、およびNPの調製におけるエネルギー効率の高いプロセスの使用が含まれます[59]。一例として、セルロース、キトサン、デキストラン、ツリーガムなどの生体高分子は、金属NP合成の還元剤および安定剤としてよく使用されます[12、60、61、62]。この研究で使用されたカラヤゴム(GK)は、ピンポンノキの天然ツリーガムです。 約13〜26%のガラクトースと15〜30%のラムノース、30〜43%のガラクツロン酸、37%のウロン酸残基、および約8%のアセチル基で構成されています[63]。毒物学的研究により、GKは無毒であることが証明され、食品添加物としても使用できるようになりました[62,63,64,65]。
この研究では、グリーンケミストリーアプローチを使用して、天然高分子GKの水溶液を使用して多くの金属(Ag、Au、Pt、Pd)および金属酸化物(CuO)NPを調製することを目的としました。これらの新しく調製されたNPの生物学的効果を Cで調査した。 reinhardtii 藻類の成長、酸化ストレス、膜の損傷、 Chl など、さまざまな細胞応答を使用します 蛍光と光合成。 NPの安定性、サイズ、ゼータ電位は、ROS生成の溶解性と非生物的テストとともに、藻類増殖培地で測定されました。
メソッド
資料
市販のGK、硝酸銀(AgNO 3 )、テトラクロロ金酸水素(HAuCl 4 ・3H 2 O)、塩化銅(CuCl 2 ・2H 2 O)、塩化白金酸(H 2 PtCl 6 )、テトラクロロパラジウム酸カリウム(II)(K 2 PdCl 4 )、塩化水素(HCl)、水酸化ナトリウム(NaOH)、水酸化アンモニウム(NH 4 OH)はすべて米国のSigma-Aldrichから購入しました。すべての実験に脱イオン(DI)水を使用しました。この研究で使用されたすべての化学物質と試薬は分析グレードでした。
C。 reinhardtii 藻類培養(CPCC11株)は、Canadian Phycological Culture Center(CPCC、カナダ、ウォータールー大学生物学部)から入手しました。
GK処理
GK粉末(1 g)を1 LのDI水を入れたガラスビーカーに入れ、マグネチックスターラーで一晩穏やかに攪拌しました。その後、ガム溶液を室温(20°C)で18時間放置して、溶解していない物質を分離しました。次に、ガム溶液を焼結ガラス漏斗(孔径10〜16μm)でろ過し、透明な溶液を凍結乾燥して、必要になるまで保存しました。
GKを使用した金属および金属酸化物NPの合成
簡単に説明すると、10 mM AgNO 3 の100μLアリコート 、HAuCl 4 、H 2 PtCl 6 およびK 2 PdCl 4 溶液を、別々の50mL三角フラスコ内の10mLのGK水溶液に加えました。コロイド分散液のpHは、NP形成の最大収率を達成するために、0.1 NHClまたは0.1NNaOHを添加することによって調整されました。 Ag、Au、Pt、およびPd NPを合成するには、AgNO 3 、HAuCl 4 、H 2 PtCl 6 、およびK 2 PdCl 4 およびGK混合物を、Innova 43オービタルシェーカー(ニューブランズウィックサイエンティフィック、米国)で、250 rpm、45〜95°Cの範囲の温度で1時間攪拌しました。溶液はそれぞれ淡黄色、ワインレッド、濃い黒、落ち着いた黒に変わり、Ag、Au、Pt、PdNPの形成を示しています。 Ptの場合、還元とNP形成はpH 8.0と温度90°Cで発生しましたが、PdNPはpH8.5と95°Cで形成されました。詳細については、Padiletalを参照してください。 [66、67]。
CuO NPは、コロイド熱合成プロセスを使用して合成されました[13]。簡単に説明すると、塩化銅二水和物(CuCl 2 )の10mM溶液の100μLアリコート ・2H 2 O)CuCl 2 を使用して、10 mLのGK溶液(100mgを10mLのDI水に分散)およびNaOHと別々の50mL三角フラスコで混合しました。 ・2H 2 OとNaOHは2:5のモル比に維持されました。 CuCl 2 を含む混合物 ・2H 2 OとGKをオービタルシェーカーで250rpm、75°Cの温度で1時間攪拌しました。混合物の色は徐々に青みがかった色から黒色に変化し、CuONPの形成を示しています。得られた沈殿物を遠心分離により得、最初にエタノール、次に脱イオン水で洗浄した。
グリーン合成NPの特性評価
新たに合成されたNP内の金属濃度は、誘導結合プラズマ質量分析(ICP-MS、OPTIMA 2100 DV、Perkin Elmer)を使用して測定されました。
金属NPの形成と安定性は、Cintra 202 UV-Vis分光光度計(GBC、オーストラリア)を使用して評価され、NPの安定性は6か月後に測定されました。
Ag、Au、Pt、Pd、およびCuO NPの透過型電子顕微鏡(TEM)画像は、15kVの加速電圧で動作するTecnaiF 12顕微鏡(FEI、Thermo Fisher Scientific、オレゴン、米国)を使用して取得しました。 TEM分析用に、10〜20μLのGK-無機NP分散液を銅グリッドに滴下し、余分な溶液を除去した後、室温で乾燥させることにより、サンプルを準備しました。
藻類の培養条件
クラミドモナスreinhardtii TAPx4培地(追加ファイル1:表S1、サポート情報)で、100 rpmで連続的に回転するシェーカーと114.2μmolphotm -の照明レジームを備えたインキュベーター(Infors、スイス)で20°Cで培養しました。 2 s -1 。藻類細胞は、約10 6 を得るために、指数関数的に成長しました。 細胞/ mL。
藻類曝露培地中のNPの特性評価
CでのNPサイズ分布。 reinhardtii TAPx4培地は、DC24000UHRディスク遠心分離機(CPS Instruments Inc.、米国)で示差遠心沈降法(DCS)を使用して測定しました。測定は24,000rpmのディスク回転速度で行われ、粒子の沈降は8〜24%( w )を使用して実行されました。 / w )ショ糖密度勾配。各サンプル測定の前に、PVCナノスフェア標準(470 nm)を使用して機器を校正しました。 NPは、電気泳動移動度、およびZetasizer ZS(Malvern Instruments Ltd.、UK)のゼータ電位(ZP)を決定するために使用されるSmoluchowski近似によっても特徴づけられました。各測定は、10秒の自己相関関数を使用して10回にわたって実行され、各結果は同じサンプルの3回の測定から取得されました。
限外濾過法を使用して、藻類培地中のイオン金属の量を測定しました(Cheloni etal。[47]; Ma et al。[68])。異なる時間間隔(2時間と24時間)で採取したアリコートを7500 rpmで30分間遠心分離し、粒子と凝集体を分離しました。次に、上澄みを、分子量カットオフが3kDaのAmicon Ultracel 3K限外濾過フィルター(ミリポア、米国)で濾過して、粒子からイオンを分離した。直径が1.3nmを超えるNPと凝集体をフィルターに保持し、ろ液をICP-MSで溶存イオンについて分析しました[68]。
藻類培地中のNP濃度の増加に伴う非生物的ROS生成は、蛍光ジクロロジヒドロフルオレセインジアセテート(H 2 DCF-DA、Sigma-Aldrich、スイス)、以前の研究[47、69]で説明されています。
藻類の成長、膜の完全性、酸化ストレスの発生に対するNPの影響
藻類の成長、膜の完全性、および酸化ストレスの生成に対する金属および金属酸化物NPの影響を、フローサイトメトリー(FCM; BD Accuri C6 Flow Cytometer、BD Biosciences、USA)を使用してテストしました。実験は、5 mLの藻類懸濁液と1、5、10、および20 mg / Lの濃度のNPを含む透明なバイアル(PS、50 mL、Semadeni、スイス)で実行されました。 NPのないコントロールサンプルは並行して実行されました。損傷した細胞膜を確実に制御するために、藻類の細胞を沸騰水(100°C)で15分間加熱しました。藻類細胞は、酸化ストレス(ROS)のポジティブコントロールとして、暗所で30分間、酸化種剤であるクミン(Sigma-Aldrich、USA)でも処理されました。すべての未処理サンプルおよびNPで処理されたサンプルは、培養を維持するために採用されたものと同様の条件下でインキュベートされました。 1、3、5、24時間後にサブサンプルを採取し、FCMを使用して細胞膜の完全性と酸化ストレスに対するNPの影響を評価しました。各サンプルの250μLアリコートをMicrotiter®96ウェル平底プレートに移しました。細胞膜の完全性を評価するために、ヨウ化プロピジウム(PI)蛍光プローブ(P4170、Sigma-Aldrich、米国)を最終濃度7μMでサンプルに添加しました。酸化ストレスを検出するために、CellROX®GreenReagent(ROS)(C10444、Life Technologies、USA)を、製品の説明に従ってサンプルに追加しました。要するに、PIはDNAに結合し、障害のある細胞膜を介した細胞内浸透に続いてRNAに付着しますが、健康な細胞からは除外されます。 CellROX®GreenReagentは、生細胞の酸化ストレスを測定するためのプローブです。細胞透過性色素は、還元状態では弱い蛍光を発しますが、ROSによる酸化とそれに続くDNAへの結合により明るい緑色の光安定性蛍光を示します。したがって、その信号は主に核とミトコンドリアに局在しています。 FCM測定の前に、プレートを暗所で20分(PI)および30分(ROS)インキュベートしました。次に、藻類の懸濁液を、青色の488nm励起レーザーを使用してFCMに通しました。 CellROX Greenは、FL1チャネル533/30 nmで測定され、PI赤色蛍光はFL2チャネル585/40 nmで測定され、クロロフィルa( Chla )FL3チャネル> 670nm。実験は2回繰り返して実施しました。
FCMデータは、CFlow Plusソフトウェア(BD Biosciences、USA)を使用して分析しました。 Chla の前方散乱特性と赤色の自家蛍光に基づいて、サンプルをゲート制御しました。 、NP、破片、その他の汚染物質からの信号を排除します。 Chla の自家蛍光に基づいて、細胞数、損傷した細胞膜または酸化ストレスを受けた細胞の割合、および自家蛍光データを取得しました。 (670 nm)、PIラベル付きセル(585 nm)、ROS Green(533 nm)(追加ファイル1:図S1)。
藻類光化学系IIの効率
金属および金属酸化物NP懸濁液を同じ藻類培養物に添加しました(約10 6 1、5、10、および20 mg / Lの最終濃度を達成するために、15mLガラスフラスコでcells / mL)。 NPを含まない藻類培養物を陰性対照として調製した。次に、すべてのサンプルを、元の藻類培養に使用したのと同じ条件下でインキュベーターに移しました。 AquaPen-C AP-C 100蛍光光度計(PSI Ltd.、チェコ共和国)。すべての測定は3回行った。 QYは、可変蛍光の比率( F v = F m − F 0 )最大蛍光( F m )、QY = F v : F m 光化学的消光効率の代用として使用されます[70]。 F m 最小の蛍光( F )で、照明の前後に680nmで数秒間照明を適用することによって得られました。 0 )光合成光がない場合の最小蛍光レベルでの初期測定です。
統計分析
Cに対する金属および金属酸化物NPの影響。 reinhardtii 分散分析ANOVAとダネットの検定(GraphPad PRISM、米国)を使用してテストされました。有意水準は* P に設定されました <0.05、** P <0.01および*** P <0.001。
結果
NPの形成と一次特性評価
GKを使用して合成されたAg、Au、Pt、Pd、およびCuO NPのTEM画像は、直径が2〜100 nmの範囲の十分に分離された球状のNPを示しています(図1a〜e)。 UV-Vis分光法(図1f)で調べたコロイド状NP水溶液は、GKネットワーク内でのAuおよびAg NPの形成と一致して、412および525nmで明確な表面プラズモン共鳴を示しました。 Pt、Pd、またはCuONPでは明確な表面プラズモン共鳴は観察されませんでした。 6か月後のUV-Vis測定により、すべてのNPの安定性が確認されました。スペクトルは、新たに合成されたNPと同様の平均サイズの単一のピークを示しています(追加ファイル1:図S2)。
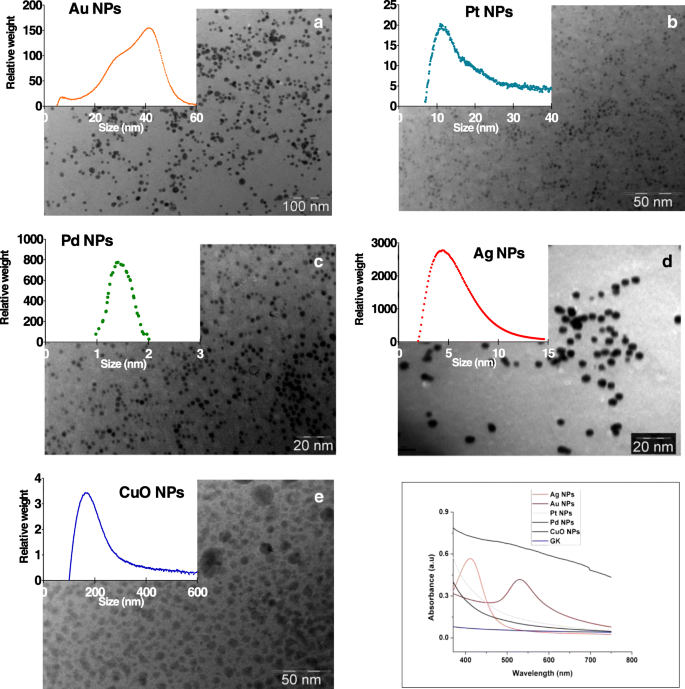
a の透過型電子顕微鏡画像 Au、 b Pt、 c Ag、 d Pdと e カラヤゴムとそれに対応する金属塩を使用して合成されたCuOナノ粒子。 a 、 b 、 c 、 d および e グラフの挿入図は、示差遠心沈降によって決定された、藻類培地中のナノ粒子重量によるピーク粒子サイズ分布を示しています。 (F)Au、Ag、Pt、Pd、およびCuOナノ粒子のUV-Visスペクトル
藻類曝露培地中のNPの特性評価
重量分布に基づくNPのサイズは、次のように180〜5nmの範囲でした:CuO> Au> Pt> Ag> Pd。すべてのNPはpH7で負に帯電しました(表1および追加ファイル1:図S3)。 Pt、Ag、およびCuO NPのイオン金属濃度は最も高く(33〜36μg / L)、AuおよびPt NPは最も低い(6〜7μg / L)(表1)。金属のイオン型が藻類培地で検出されました(表1)。
<図>藻類の成長への影響
影響を受けない C。 reinhardtii 培養物の増殖速度は1×10 6 でした セル/時間。 1 mg / LのAg、Pd、およびCuO NPの存在下では、成長速度は2.2×10 4 に急激に低下しました。 、1.7×10 4 および0.2×10 4 それぞれセル/時間( P <0.001)。 NP濃度がさらに上昇すると、藻類の成長は完全に抑制されました(図2)。藻類がAuおよびPtNPに曝露された場合、成長率も対照と比較して大幅に低下しました( P <0.001)、ただし濃度を上げても効果は上がりませんでした。
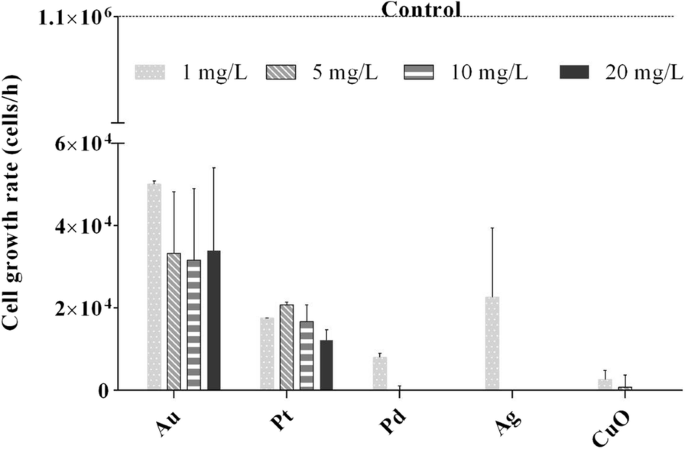
クラミドモナスの成長率 Au、Pt、Pd、Ag、CuOの金属および金属酸化物ナノ粒子(1、5、10、および20 mg / L)にさらされます。非曝露対照(藻類培養)の増殖速度は1×10 6 でした。 24時間後のセル/時間。エラーバーは、重複サンプルを使用した繰り返し実験の標準偏差を表します
細胞内の酸化ストレスの生成
酸化ストレスはNPの種類によって異なります(図3)。ほぼ100%の細胞が影響を受けた最大の影響は、5〜20 mg / LのAgおよびCuONPによって引き起こされました(図3d、eおよび追加ファイル1:表S2)。藻類細胞がAuNPに曝露された場合、酸化ストレスははるかに低く、ほとんどの場合、細胞の<10%が影響を受けました。最高濃度のAuNP(20 mg / L)は、細胞の15%にしか影響しませんでした( P <0.001)。ストレスを受けた細胞の割合は時間の経過とともに徐々に減少し、テストしたすべてのAu濃度で24時間後に酸化ストレスは検出されませんでした(図3a)。 Pt NPは、曝露の最初の5時間に、藻類細胞の8%未満で酸化ストレスを引き起こしました(図3b)。 10および20mg / Lの濃度でのみ、24時間後にそれぞれ10%および19%の細胞でストレスが発生しました( P <0.001;追加ファイル1:表S2)、低濃度( P )でストレスが検出されない> 0.1)24時間の曝露後(図3b)。 1 mg / LのAgNPへの曝露は、24時間にわたって藻類細胞に酸化ストレスを誘発することができませんでした( P > 0.9)。ただし、5 mg / Lに曝露すると、5時間後に酸化ストレスが発生し、10および20 mg / Lに曝露すると、3時間後に酸化ストレスが発生しました。 Ag NPに24時間曝露した後、100%の細胞にストレスがかかりました( P <0.001;図3cおよび追加ファイル1:表S2)。 CuO NPは有意な( P <0.001)Ag NPを除き、10および20 mg / Lでテストされた他の金属NP(追加ファイル1:表S2)よりも迅速に(3時間)藻類細胞の酸化ストレス。酸化ストレスは、5時間後に5 mg / Lですでに有意でした。すべての濃度(> 5 mg / L)は、細胞の酸化ストレスに有意な影響を及ぼしました(図3d、e)。補完的なパラメータとして、NPによって生成される非生物的ROSも決定しました。 Cとは対照的です。 reinhardtii Cの成長率とパーセンテージ。 reinhardtii 酸化ストレスを示す細胞では、Au NPは非生物的ROS( P )をわずかに増加させるだけでした。> 0.05;追加ファイル1:図S4)。
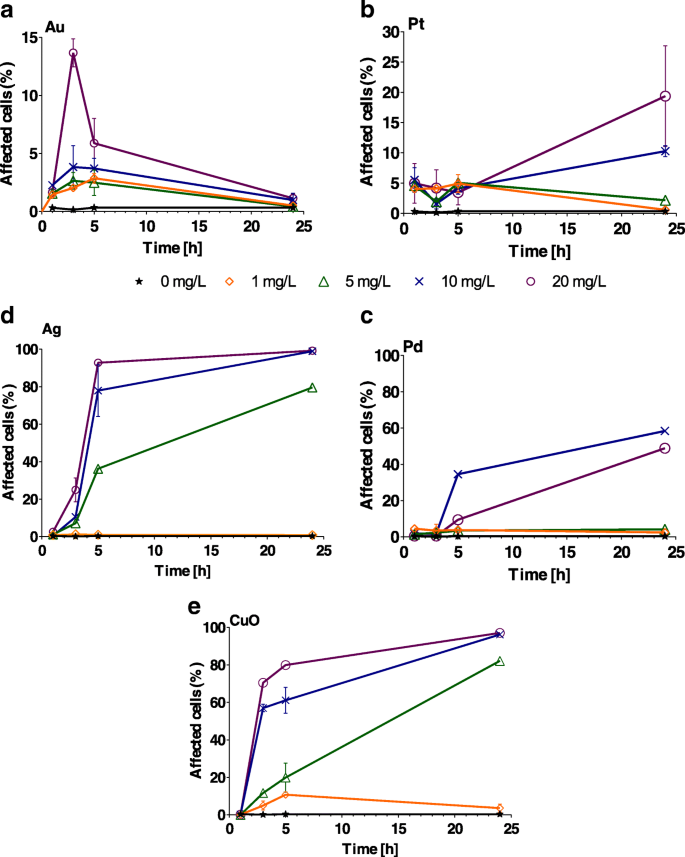
Chlamydomonas reinhardtii の割合 増加する濃度(1、5、10、および20 mg / L)の a にさらされた後、酸化ストレスを示す細胞 Au、 b Pt、 c Pd、 d Agと e 1、3、5、24時間後のCuOナノ粒子。エラーバーは、重複サンプルを使用した繰り返し実験の標準偏差を表します。異なる y に注意してください -AuとPtの軸スケール
藻類の膜の完全性への影響
AuおよびPtNPは、重大な( P <0.001)1〜5時間のすべての濃度での細胞膜損傷(追加ファイル1:表S3)。ただし、大きな影響はありません( P > 0.05)は24時間後に観察されました(図4a、b)。 Ag NPの場合、100%の細胞が損傷しました( P <0.001)1〜20 mg / Lに1時間暴露した後(図4c、追加ファイル1:表S3、Ag)。 1および5mg / LのPd NPへの曝露後に損傷した細胞膜の割合(追加ファイル1:表S3、Pd)は、24時間にわたる対照の割合( P )と同等でした。> 0.4)。一方、重大なダメージ( P <0.001)は、20 mg / LのPd NPに24時間曝露した後に観察されました(図4d)。 CuOの効果は、濃度と時間の増加とともに増加し、24時間後に最大の効果を達成しました(図4eおよび追加ファイル1:表S3)。
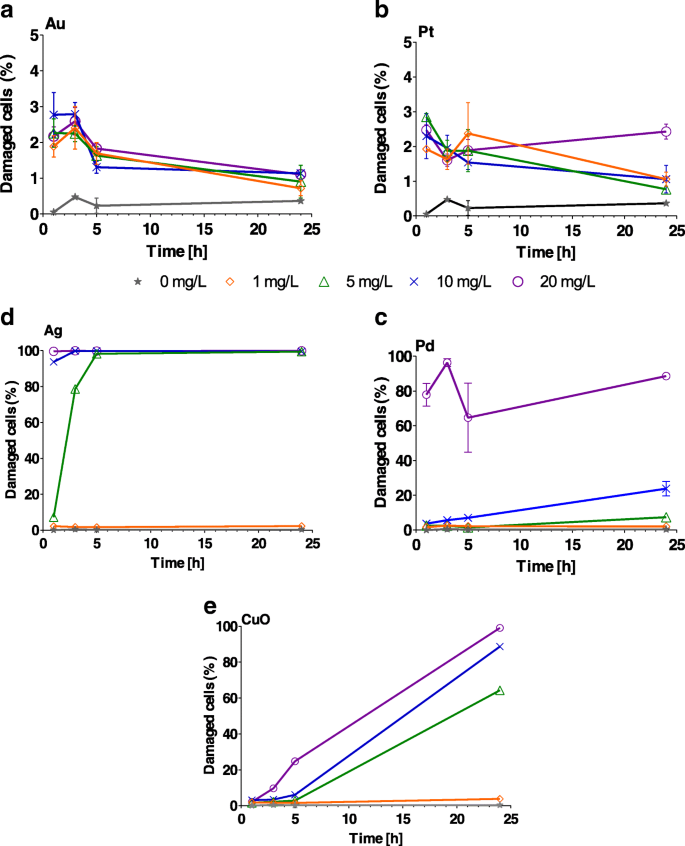
Chlamydomonas reinhardtii の割合 a の濃度を上げて(1、5、10、20 mg / L)曝露した後、膜が損傷した細胞 Au、 b Pt、 c Pd、 d Agと e 1、3、5、24時間後のCuOナノ粒子。エラーバーは、重複サンプルを使用した繰り返し実験の標準偏差を表します。異なる y に注意してください -AuとPtの軸スケール
クロロフィルへの影響( Chl )蛍光
Chl 蛍光は有意に影響を受けませんでした( P > 0.1)24時間にわたって任意の濃度のAu NPによって、5時間にわたってPtによって(図5a、bおよび追加ファイル1:表S4)。一方、Ag、Pd、CuO NPは強く阻害されました( P <0.001) Chl 濃度と曝露時間の増加に伴う蛍光、例えば Chl 蛍光は98%(1時間)から22%(24時間)に減少しました( P <0.001)5 mg / L Agの存在下で藻類細胞を増殖させた場合(追加ファイル1:表S4)。 10および20mg / L Agでも同様の蛍光の減少が観察され、レベルは20および9%に低下しました( P それぞれ<0.001)(図5c)。 CuOおよびPdNP(両方とも20 mg / L)により、 Chl が急激に低下しました。 24時間後の蛍光( P <0.001)。観察可能な影響はありませんでした( P > 0.1)ただし、1または5 mg / LのPd、および1 mg / LのAgおよびCuONPの場合(図5c–e)。
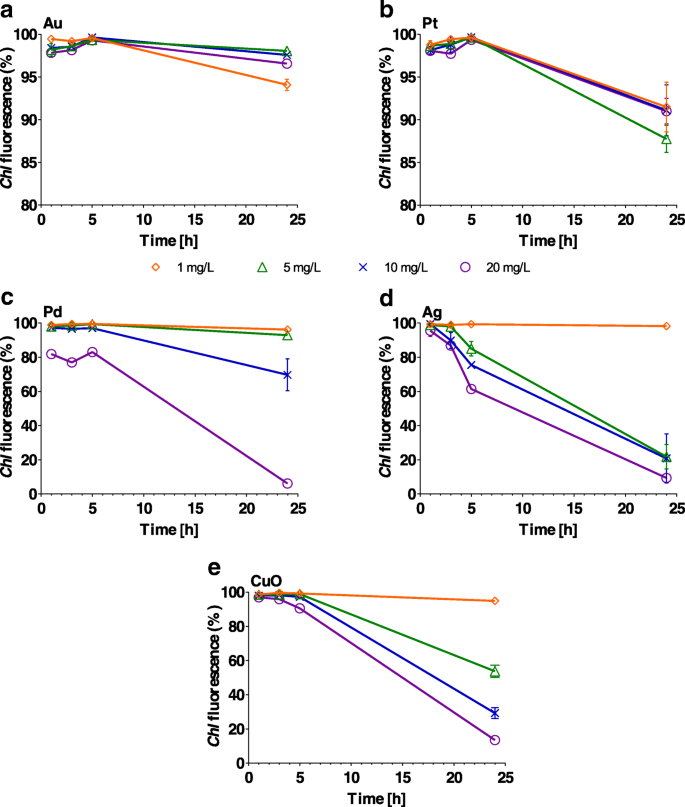
Chlamydomonas reinhardtii の割合 クロロフィルを含む細胞( Chl ) a の濃度を上げて(1、5、10、20 mg / L)曝露した後の蛍光 Au、 b Pt、 c Pd、 d Agと e 1、3、5、24時間後のCuOナノ粒子。エラーバーは、重複サンプルを使用した繰り返し実験の標準偏差を表します
藻類光化学系IIに対するNPの影響
Au、Pt、およびCuO NPは、わずかに有意な影響を及ぼしました( P <0.05)1〜20 mg / Lの範囲の濃度で24時間のある時点での光化学系IIQY(図6および追加ファイル1:表S5)。一方、QYは大幅に減少しました( P <0.001)すべての濃度のAg NPと接触してからわずか1時間後(図6cおよび追加ファイル1:表S5)。 PdおよびCuONPは、20 mg / Lの最高濃度でQYの大幅な低下をもたらしました(図6d、eおよび追加ファイル1:表S5)。
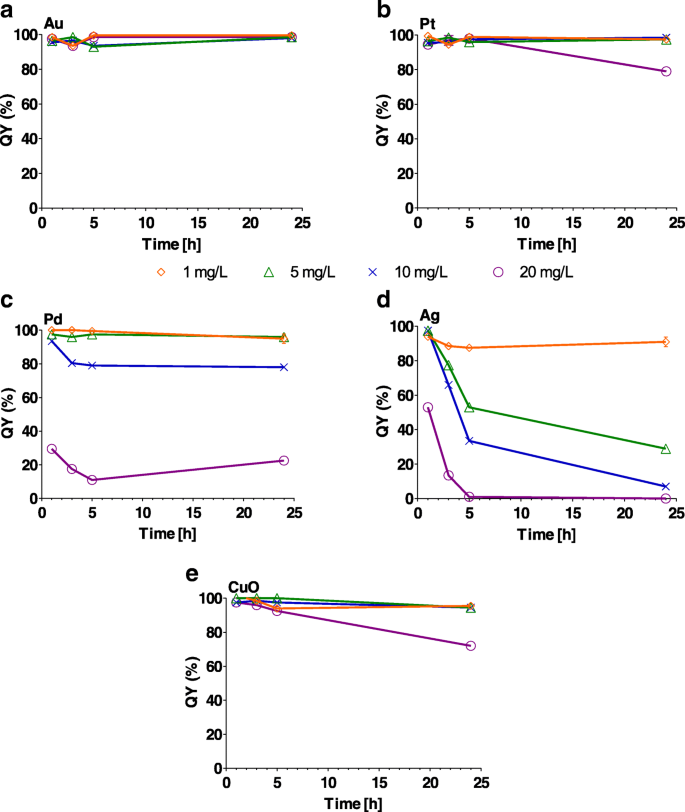
a の効果 Au、 b Pt、 c Pd、 d Agと e 1、3、5、および24時間後の光化学系II効率(QY%)でのCuOナノ粒子(1、5、10、および20 mg / L)。 y の100% -軸は、ナノ粒子を含まない対照藻類培養のQYを表します。エラーバーは、複製されたサンプルの繰り返し実験の標準偏差を表します
ディスカッション
本研究では、グリーンケミストリーアプローチ[16、57、58]の実施において、金属および金属酸化物ナノ材料の合成中の有毒廃棄物の生成の排除を探求することを目的としました。再生可能で生分解性の材料。さまざまなNPの合成と安定化に、天然の再生可能で生分解性の材料であるGKを使用することに成功しました。溶媒としてDI水を使用すると、GKに存在する官能基(つまり–OHおよび–COO–)が還元剤として機能し、GKポリマー自体が形成されたNPのキャッピング剤として機能し、NPのグリーン合成が可能になります[59、 68]。私たちの研究で合成されたNP(Au、Pt、Pd、Ag、およびCuO)は、サイズ、安定性、費用効果の点で、以前の研究からの他のグリーン合成NPと同等でした[13、69]。
次に、予想または記録された環境濃度に関連する一連のナノスケール濃度(1〜20 mg / L)[39、71、72、73]を使用して、 Cに対するNPの生物学的影響を評価しました。 reinhardtii 藻類の成長、膜の完全性、 Chl などのエンドポイントを使用する 蛍光光化学系IIの効率と酸化ストレス。その結果、2つの異なるグループが明らかになりました。AuとPt NPは藻類にほとんどまたはまったく影響を与えず、Ag、Pd、CuO NPはほとんどすべてのエンドポイントに強い影響を示します(追加ファイル1:表S6)。金属または金属酸化物NPの毒性研究により、組成、コーティング、サイズ、形状、ホモまたはヘテロ凝集など、毒性に関連する可能性のあるNPのいくつかの重要な物理化学的特性が特定されました[69、74、75、76、77、 78]。さらに、溶存金属(イオン形態)の毒性は、細胞内ROS生成、 Chl などのさまざまな基準を使用して、藻類で以前に実証されています。 枯渇と光合成阻害[79,80,81]。 ROSの生成と成長への影響を明確に検出しました Chl Ag、Pd、CuONPへの曝露後の生産と光化学系II。
Pd NPは通常毒性群と見なされてきましたが、広く研究されておらず、重要な抗菌NPとして最近認識されたばかりです[41]。一般に、Pd NPのサイズが小さい(1.5〜3 nm)と、抗菌性が高まり、直径が5〜20nmの細菌や藻類の細胞壁の細孔を介した細胞への輸送が促進されると考えられています[82、83]。 。 In our study, Pd NPs of 1.5 nm mean size could directly enter algal cell walls and cause damage when releasing ions in the cell membrane and chloroplasts (Chl fluorescence, PS II, ROS). There is clear evidence that soluble Pd salt was able to enter P. subcapitata cells, where Pd precipitates were mostly formed in chloroplasts [78] which could increase generation of ROS and thus oxidative stress. It was also reported that Pd NPs (127 nm z -average hydrodynamic size) were less toxic toward P. subcapitata than soluble Pd salt [69] maybe due to larger size of NPs that could not directly enter the cells, while Pd salt could. On the other hand, Pd NPs could form hetero-aggregates with algal cells leading to physical entrapment. Surprisingly, the entrapment is not inevitably lethal because the cells could recover their growth after transfer to clean medium [69].
Numerous studies have shown that Ag NPs toxicity to algae was mainly driven by Ag ions dissolved in the exposure medium rather than Ag NPs and also depended on Ag NPs coatings and sizes [80, 84,85,86,87,88,89]. Our study revealed high toxicity of Ag NPs thus suitable for algicidal applications. The ionic Ag and/or Ag NPs (5 nm) could directly enter algal cells [90], causing damage to the cell membranes and other cellular compartments by ROS formation. Moreover, Ag NPs could damage algal cells by direct interaction between NPs and algal cells [72] or the type of NPs coating could play a significant role. For example, dexpanthenol, polyethylene glycol and polyvinyl polypyrrolidone coatings caused a similar effect as AgNO3 on C. reinhardtii , while carbonate, chitosan, and citrate decreased the Ag effect on photosynthesis [87]. Our Ag NPs showed strong effect toward C. reinhardtii regardless GK coating.
The ecotoxicity of CuO NPs has been extensively studied [36, 47,48,49, 69, 91]. We observed CuO NPs harming cell membranes right after 1 h, while the ROS elevated after 3 h at concentrations higher than 5 mg/L and also Chl fluorescence substantially decreased over 24 h. It is possible that the CuO NPs (or ionic Cu)-damaged membranes could increase further uptake of Cu and oxidative stress in the C. reinhardtii cells [91] where observed hetero-aggregation of NPs and the cells (data not shown) could even enhance this interaction. von Moos et al. [36] stated that free Cu 2+ or the NPs themselves were the main mediators of toxicity toward C. reinhardtii , while Cheloni et al. [47] believed ion Cu at lower CuO NPs concentrations was the driving force, being unable to clarify the contribution of dissolved Cu in CuO NPs . This was probably elucidated by other study revealed much stronger effect of soluble ionic Cu and soluble fraction of CuO NPs on P. subcapitata than bare CuO NPs [69].
Au NPs slightly increased membrane impairment and oxidative stress after 3 and 5 h, but these effects disappeared after 24 h. Interestingly, abiotic ROS were constantly generated during whole 24 h study contrary to all other NPs. We assume that stable conditions allowed the cells to cope with such small level of stress. Previous study has reported a range of EC50 values for dissolved Au on C. reinhardtii of between 5.9 and 1.7 mg/L, depending on exposure time [92]. In our opinion, almost any Au NP toxicity would not have been exacerbated or affected by the degree of ion Au and would have had nearly no bearing on any of the criteria adopted for our experiments. Moreover, Au NPs seemed to be well dispersed in exposure media and we did not observe any aggregates or direct interactions with the C. reinhardtii cells (data not shown).
We found that Pt NPs caused slight Chl and a growth rate decrease after 24 h for all concentrations. These not so pronounced effects could be caused by both ionic Pt and Pt NPs. Up to now, there has been only limited knowledge about the toxicity of Pt NPs on algae. For example, Pt NPs decreased growth rate, and Chl fluorescence and oxidative stress on P. subcapitata and C. reinhardtii [39, 40]. The latter authors also suggested that the toxicity of Pt NPs might be only partly attributed to dissolved form of Pt in the case of P. subcapitata and that also the shading effect might influence toxicity [40]. In our study, we did not find such evidence.
Conclusions
Green-synthesised metal and metal oxide NPs were produced at nanoscale sizes of 42 nm (Au), 12 nm (Pt), 1.5 nm (Pd), 5 nm (Ag) and 180 nm (CuO):all with a negative charge. GK, a natural hydrocolloid, was successfully applied as a safe, cost-effective stabiliser and showed no aggregation (all NPs) after 6 months at + 4 °C. The biological effect (algal growth, membrane integrity, oxidative stress, Chl fluorescence and photosystem II efficiency) of these NPs was investigated on green alga C. reinhardtii 。 All NPs had a significant effect on algal growth rate; however, Au and Pt NPs inhibited algal growth far less than the other NPs (Pd, Ag and CuO). In terms of other biological effects, Pd, Ag and CuO NPs caused significant cell membrane damage, highly affected Chl fluorescence and caused oxidative stress. Ag and Pd NPs mostly inhibited photosystem II, while it was not much affected by CuO (only the highest concentration of 20 mg/L significantly decreased QY) and Au or Pt. Generally, metal and metal oxide NPs were successfully synthesised following green chemistry rules, without harmful side-products and showing high stability. Some could find reasonable application in algicides (Ag and CuO) or antimicrobial surfaces (Pd, Ag and CuO), while Au and Pt proved to be almost non-toxic to green alga C. reinhardtii 。
ナノマテリアル
- ICAをロードしたmPEG-ICAナノ粒子の調製とLPS誘発性H9c2細胞損傷の治療におけるそれらの応用
- Escherichia coliに対する酸化銅ナノ粒子の生体合成、特性評価、および抗菌力の評価
- MnХFe3−XО4スピネルの構造的および磁気的特性に及ぼす接触非平衡プラズマの影響
- リチウムイオン電池用の金属酸化物アノードの電気化学的性能に及ぼす異なるバインダーの影響
- 光熱治療および光音響イメージングのためのポリピロール被覆鉄-白金ナノ粒子の合成およびinvitro性能
- 蒸発誘起自己組織化と強化されたガス検知特性によるワームホールのようなメソポーラス酸化スズの容易な合成
- La1 − xSr xMnO3マンガン酸塩ナノ粒子の合成方法がそれらの特性に及ぼす影響
- 銅ナノ粒子の合成と安定化におけるグリーン熟達度:触媒、抗菌、細胞毒性、および抗酸化活性
- 金および銀ナノ粒子のグリーン合成のためのPlatycodiRadix(Platycodon grandiflorum)からのPlatycodonサポニン
- 丸い形の金ナノ粒子:シロイヌナズナの根の成長に対する粒子サイズと濃度の影響
- グリーンサプライチェーンへの道の道標と障害物



