強化された安定性と抗菌活性を備えたフレームワークへのカーボンドットの組み立て
要約
カーボンドット(CD)は、その活性表面のために抗菌剤として広く使用されてきましたが、一部のCDは不安定になります。したがって、抗菌活性などの相対的な用途は、長期間の使用には信頼できない可能性があります。ここでは、水熱プロセスによって青色蛍光のCDを合成します。その後、ポリエチレンイミンは、CDをCDベースのフレームワーク(CDF)に組み立てるために適用されました。 CDFは消光蛍光を示しましたが、走査型電子顕微鏡とゼータ電位の調査に基づいて、より安定した特性を示しました。 CDとCDFはどちらも、グラム陰性大腸菌( E. coli )に対して抗菌活性を示します。 )およびグラム陽性黄色ブドウ球菌 (黄色ブドウ球菌 )、しかしCDFはより良い抗菌性能を示し、 S。アウレウス 最小発育阻止濃度30μg/ mLで完全に抑制できます。これは、CDFが安定性と抗菌活性の両方を拡大することを示しています。これは実際のアプリケーションにとってより有望です。
グラフィックの要約
はじめに
細菌感染症は人命に深刻な脅威をもたらし、細菌を消毒するための効果的な医薬品の開発が強く求められています[1]。細菌感染症の治療にはさまざまな抗生物質が使用されてきましたが、抗生物質の乱用は副作用や薬剤耐性の問題などの他の問題を引き起こします[2]。抗菌性ポリマー[3]、金属ナノ材料[4]、およびカーボンナノ材料[5、6]を含むナノ材料は、古典的な抗生物質[7]の代替品として使用されてきました。薬剤耐性と毒性の両方の問題が緩和されています[8]。最近、CD [9、10]およびナノクラスター(NC)[11]は、生体適合性[12]、活性[13]であり、サイズが非常に小さいため循環によって簡単に洗浄できるため、細菌感染症との闘いによく適用されています。 [14、15]。特に、研究者は、CDが優れたフリーラジカル捕捉能力を示すことを発見しました。これは、多くの従来の抗感染薬よりも強力である可能性があります[16、17、18]。ただし、一部の超小型抗菌剤は、酸化表面積が大きいために安定性が低くなります[19]。長期使用のために細菌感染症と戦うためのより効果的な抗菌剤を開発することが強く望まれています。
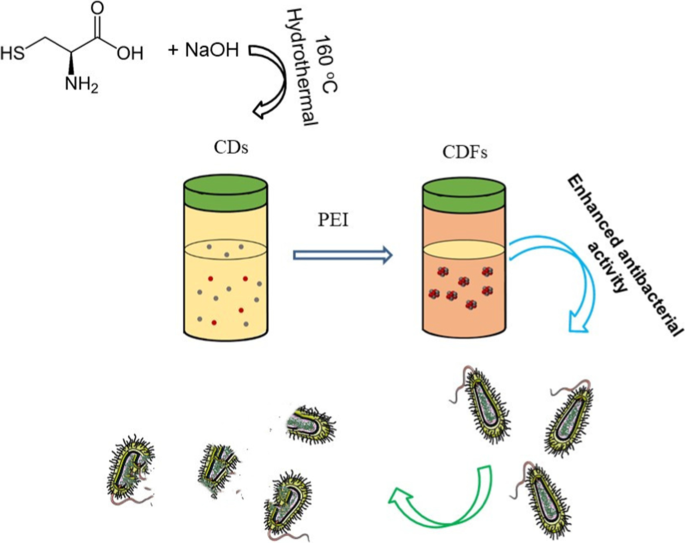
実用的なアプリケーションの需要を満たすために、抗菌剤は次の特性を備えている必要があります。(a)優れた安定性は、周囲環境で一定時間変化しません。 (b)優れた生体適合性と低毒性:(c)高い抗菌活性。大きなナノ材料はより安定する傾向がありますが、活性表面積が小さいため、抗菌活性が比較的弱い可能性があります。小さいナノ材料と大きいナノ材料の両方の弱点を考慮して、ポリエチレンイミン(PEI)を追加するだけで小さいCDが大きいCDFに組み立てられることを報告します(図1)。 CDは融合されませんでしたが、ビルディングブロックとしての形態を維持しました。したがって、CDF全体がより大きなサイズを示しましたが、CDのアクティブな特性を失うことなく、より優れた安定性を示しました。さらに、CDFは、グラム陰性大腸菌( E. coli )の両方に対して強化された抗菌活性を示すことがわかりました。 )およびグラム陽性黄色ブドウ球菌 (黄色ブドウ球菌 )CDと比較して、広域スペクトルの抗菌性能を示していますが、多くのCDはグラム陽性菌のみを根絶しました[20]。さらに、CDFはPC12細胞(ラット副腎髄質の褐色細胞腫から得られた細胞株)の増殖を促進し、神経回復への応用に大きな可能性を示しています[21]。この作業は、小さなCDを大きなCDFに組み立てることで、安定性が向上するだけでなく、抗菌活性が向上することを示唆しています。
抗菌活性が強化されたPEIを追加することによるCDの合成とCDFへの組み立てのスキーム
材料と方法
材料と器具
X線表面光電子スペクトル(XPS)は、ESCALAB250Xi X線表面光電子分光法(XPS)装置で記録されました。透過型電子顕微鏡(TEM)は、200kVで動作するJEM-2100顕微鏡によって実行されました。材料の蛍光は、F97蛍光分光計を使用して得られた。細菌細胞のFDA / PI染色は、ライカDFC450C顕微鏡を使用してタッピングモードで記録されました。 Nanolog分光蛍光光度計(Horbia JY、日本)を使用して、時間相関単一光子計数(TCSPC)システムで蛍光寿命を測定しました。紫外可視分光法(UV-vis)スペクトルは、UV-1600装置から取得されます。細菌の画像は、共焦点顕微鏡(Olympus FLUOVIEW FV1000 c)で観察しました。すべての試薬は分析グレードのものでした。実験では脱イオン水を使用しました。細胞計数キット-8はBeyotimeBiotechnologyから入手しました。
CDおよびCDFの準備
L-システイン(1.0 g)を10.0 mLの脱イオン水に溶解し、よく混合しました。次に、溶液のpHを1.0 MNaOHで9.0に調整しました。溶液を熱水反応器に移し、160℃で24時間加熱しました。溶液を室温まで冷却した後、得られた溶液を、透析バッグ(MW 7000カットオフ)を使用して1日透析にかけた。得られたCDは、以下の特性評価と実験に使用されました。 CDFを準備するために、40 µLの1%PEIを1mLのCDに追加しました。混合物を1時間放置した。 CDの精製と同じ方法を使用して、生成物を透析によって精製した。 HR-TEMの特性評価では、サンプルを少量に濃縮し、シリカゲルカラムに移し、メタノールとジクロロメタンで溶出して、さらに精製された生成物を得ました。
毒性評価
PC12細胞を96ウェルプレートに12時間播種し、CDおよびさまざまな濃度のCDFとインキュベートしました。生細胞の数は、Cell Counting Kit-8アッセイ(CCK-8)を使用して調査しました。 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド(MTT)(PBS中5 mg / mL)を1/10の培養液量で添加し、細胞をインキュベーターに戻しました。その後、上澄みを廃棄し、200μLのジメチルスルホキシド(DMSO)を各ウェルに加えた。プレートを10分間振とうすることにより、結晶を溶解しました。 Microreader(Varioskan LUX Multimode Reader)を使用して、490nmでの吸光度を測定しました。すべての吸光度測定には、ブランクのコントロールウェルが含まれています。
抗菌実験
E。コリ および S。アウレウス CDおよびCDFの非存在下および存在下で、37°C、250rpmで振とうしながらインキュベートしました。溶原ブロス(LB)培養での細菌細胞の増殖は、マイクロリーダーによって600 nmの波長(OD600)で測定されました。ブランクコントロールとしてLB培地を使用しました。 OD600は細胞密度を表し、相対的な細胞生存率は、材料の存在下で培養された細菌細胞と対照群(CDまたはCDFの非存在下での細菌細胞のOD600)との比較に基づいて計算されました。生菌/死菌はFDA / PI染色プロトコル[22]によって評価されます。
Ros活性酸素種(ROS)の検出
細胞内ROS産生は、CDおよびCDFによる12時間の処理の前後に、指示に従って2 '、7'-ジクロロフルオレセインジアセテート(DCFH-DA)プローブを使用して細菌細胞で測定されました。蛍光は、発光波長525 nm、励起波長488nmで検出されました。
結果と考察
材料の特性評価
サイズ調査
図2は、空気に数時間さらした後の比較的低い倍率(図2a0)と高い倍率(図2b0)のCDFの粉末のSEMを示しています。 CDFは十分に分布しており、平均サイズは約1mmであることがわかります。 25nm。 CDは、TEMおよびAFM研究に基づいて単分散の小さなサイズを示すはずでしたが(追加ファイル1:図S1)、これらの小さな粒子は、一定時間空気にさらされた後、SEMによる凝集観察を示しました(追加ファイル1:図S2 )。一方、CDFは、周囲環境にさらされても形態を維持していました。これは、入手したCDFが実際のアプリケーションにとってより有望であることを示しています。 CDFは、TEMによってさらに特徴づけられました(図2b1)。 CDFは、小さなCDを構成要素とするアセンブリ構造を示していることがわかります。高分解能透過型電子顕微鏡(HR-TEM)(図2b2)分析により、CDFのビルディングブロックは、グラファイトの(100)平面格子に対応する0.21nmのd間隔の格子縞を示したことが明らかになりました。古典的なCD [23,24,25]に似ています。したがって、アセンブリCDFはCDの機能を失うことはなく、大きなフレームワーク全体と内部の小さなビルディングブロックの両方の利点を組み合わせることができます。

比較的低い( a0 )CDFのSEM )およびより高い倍率( b0 ); TEM( b1 )HR-TEM( b2 )CDFの
ゼータ電位
ゼータ電位調査を使用して、分散システム内の隣接する荷電粒子間のCDおよびCDFの静電反発の程度を測定しました(図3)。周囲環境にさらされたCDのゼータ電位ピークは十分に特徴づけられていなかったことがわかります。さらに、複数のゼータ電位ピークが大きなゼータ偏差で得られ(表1)、CDが非常に不安定で再現性がないことを示しています。一方、CDFのゼータ電位ピークは比較的安定した範囲に集中していました。また、3回の測定に基づくゼータ偏差ははるかに小さく、CDFはより安定しており、分散システムにはより高い純度のサンプルが含まれていることがわかりました。
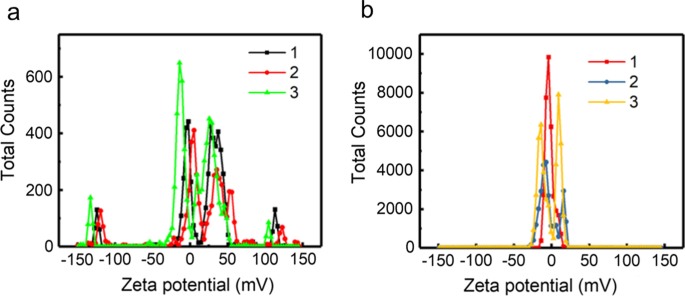
CDのゼータ電位( a )およびCDF( b )
蛍光特性
蛍光発光スペクトルを使用して、CDからCDFへの組み立てプロセスを監視しました(図4)。 PEIの滴定として、350 nmでの蛍光発光は徐々に消光しました(図4a)。しかし、有意な蛍光スペクトルシフトは観察されず、凝集が起こらなかったことを明らかにした。 CDFのアセンブリ構造は、CDの全体のサイズを変更し、蛍光に影響を与えます。その間、近くのCDはお互いの蛍光をマークしました。これと同様に、表面化学は蛍光特性において重要な役割を果たします。 CDの表面の窒素原子と硫黄原子はエネルギートラップを生成する可能性があります。 CDの明るい蛍光は、多くのカルボニル基とアミノ基を持つ欠陥表面に起因します。 PEIの官能化後、CDFの表面はアミノ基によって支配され、サイズの増大とともに蛍光を消光しました。 CDとCDFの蛍光挙動の比較は、材料の光生成電荷再結合経路を理解するためにTCSPCによってさらに調査されました(図4b)。発光は430nmで監視されました。蛍光減衰には、2成分の指数関数的適合が必要でした。時定数と相対振幅が適合され、表S1に要約されています。 CDの主要コンポーネントの寿命は2.45nsでしたが、他のコンポーネントの寿命は7.47nsであることがわかりました。一方、CDの主要コンポーネントの寿命は1.98 nsでしたが、他のコンポーネントの寿命は7.30nsでした。 CDとCDFの間に有意な寿命の変化は観察されませんでした。これは、CDFへの組み立て中にCDの特性が実質的に変化しなかったことも示しています[26]。
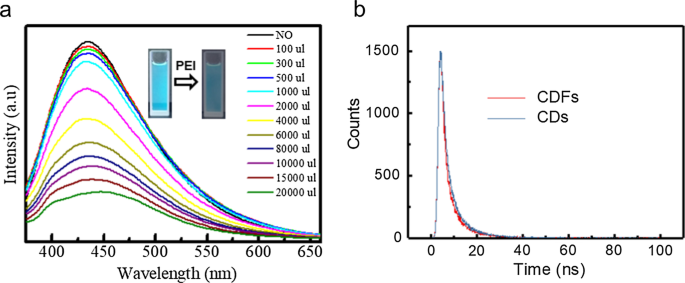
蛍光発光スペクトル a PEIの滴定としてのCDの量、および寿命 b CDおよびCDFの場合
毒性
材料の安全性を評価するために、PC12細胞に対するCDおよびCDFの毒性を調査します。 MTTのアッセイは、細胞生存率に対する材料の影響を調査するために実施されました(図5)。 PC12をCDおよびCDFとインキュベートした後、24時間以内に細胞の生存率に大きな影響はありませんでした。興味深いことに、両方の炭素材料は、神経損傷の治療に重要な役割を果たすPC12の増殖を促進します。これらの結果は、材料の毒性が低いことを示しており、材料は、関与するPC12細胞による神経保護に有望です[27]。
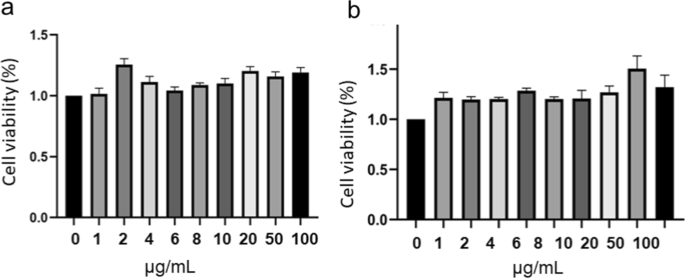
CDの存在下でのPC12の細胞生存率( a )およびCDF( b )。細胞生存率(%)=(実験群の吸光度-ブランク群の吸光度)/(対照群の吸光度-ブランク群の吸光度)×100%
抗菌調査
CDおよびCDFの抗菌活性は、最初に600nmでこれらの薬剤の存在下で細菌密度を測定することによって評価されました[28]。図6は、両方の Sに対するCDとCDFの両方の実質的な抗菌効果を示しています。アウレウス および E。コリ 細胞。特に、 Sの実行可能性。アウレウス 30 µg / mLを超えるCDFを使用した場合、細胞はほぼ0でした。同様に、 E。コリ 細胞はCDとCDFの両方で消毒されました。 CDは複数の電荷を示しました(図3a)。一方、CDFの電荷はわずかであり(図3b)、弱い反発力の下で細菌の付着を抑制し、細菌の表面とより簡単に相互作用する可能性があります。比較すると、CDFは、6 µg / mLを超える材料を使用すると、比較的大きな比率の細胞が死滅するという現象に基づいて、より高い抗菌活性を示します。 CDFの強化された抗菌活性は、ビルディングブロックとしてのCDの相乗効果と、より安定した表面電荷に起因する可能性があります。抗菌メカニズムを深く理解するために、非蛍光DCFHを蛍光DFCに酸化する可能性のあるROSを測定しました(図6C)。両方の炭素材料は、 Eを処理した後にROS生成を有意に誘発しなかった。コリ 。しかし、CDFは Sと相互作用している間、細胞内ROSを著しく増強しました。アウレウス 。 ROSはバクテリアのDNA、RNA、およびタンパク質に損傷を与える可能性があるため、値を上げるとバクテリアの消毒が容易になります。さらに、ROSはH 2 で刺激されました O 2。 H 2 と比較して、ROSの制作がすべて劇的に促進されたことは注目に値します。 O 2 CDFが最高の増強を示したのに対し、治療のみ。これは、H 2 の組み合わせを示しています O 2 これらの2つの炭素材料を使用すると、特にCDFの抗菌活性がさらに向上する可能性があります。
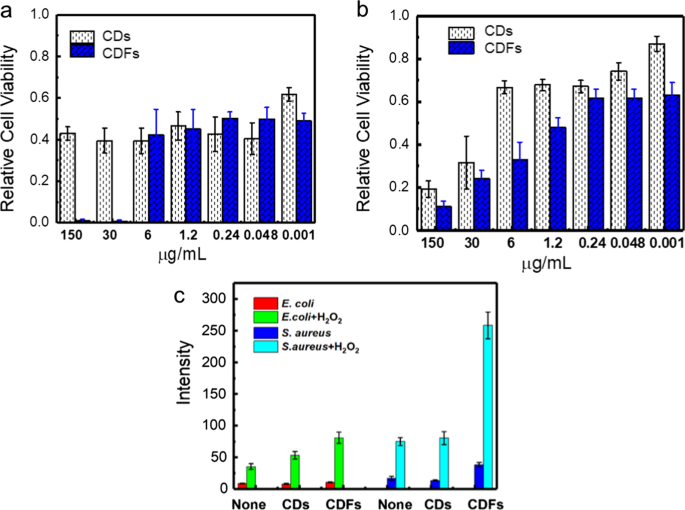
Sに対するCDおよびCDFの抗菌活性。アウレウス ( a )および E.coli ( b )、 c H 2 の非存在下および存在下でのCDおよびCDFの処理で、ROSレベルと線形関係を示す525nmでのDCFの蛍光強度 O 2 (100μM)
一部のCDは、 Sの消毒について以前に報告されています。アウレウス 、比較のために表2にリストされています。現在のCDFは競争力のあるMICを示しました。さらに、CDFは、調査対象の細胞生存率を低下させるだけでなく、PC12の細胞増殖を促進し、細菌感染症の治療中の多様性を示しています。
<図>CDおよびCDF処理後の細菌膜の完全性は、生/死染色実験によって調査されました(図7)。緑色蛍光FDA染色は生細胞のみを表示でき、赤色蛍光PIは膜が壊れた死んだ細菌を特異的に染色しますが、細菌膜が無傷の生きた細菌は染色されません[30、31]。蛍光画像に示されているように、CD処理サンプルでは明らかな赤色蛍光が見られ、CDF処理サンプルでははるかに高密度の死細胞が見られました。
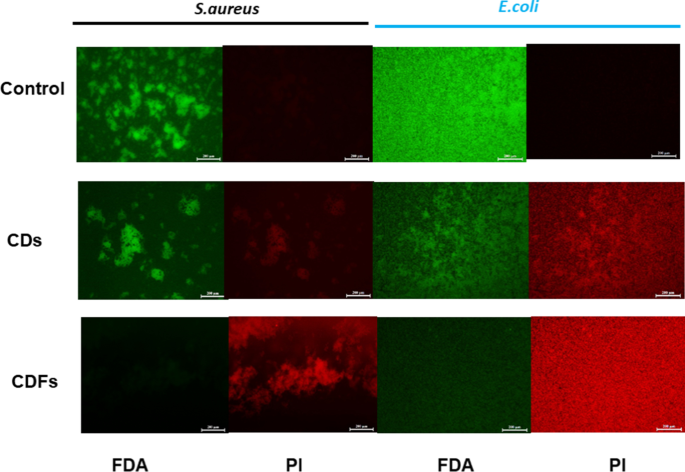
FDA / PI染色 S。アウレウス および E。コリ 30 µg / mLのCDおよびCDFの非存在下および存在下。スケールバー、200 µm
上記の比較に基づいて、CDFはグラム陽性菌とグラム陰性菌の両方を殺すために有望であると結論付けます。したがって、 E。コリ および S。アウレウス 30 µg / mLのCDFで処理する前後で、SEMによって特徴づけられました(図8)。図8a、cに示すように、CDFで処理する前の細菌は規則的な表面を示します。しかしながら、CDFとインキュベートした後、 Sを含む細菌細胞の形態。アウレウス (図8b) d E. coli (図8d)大幅に変更されました。さらに、多くの細菌細胞の膜が壊れました。付着したCDFに由来するいくつかの小さな物質が細菌の表面に観察されました。これは、CDFが膜を損傷することによって細菌細胞を消毒できることを示しています[32]。
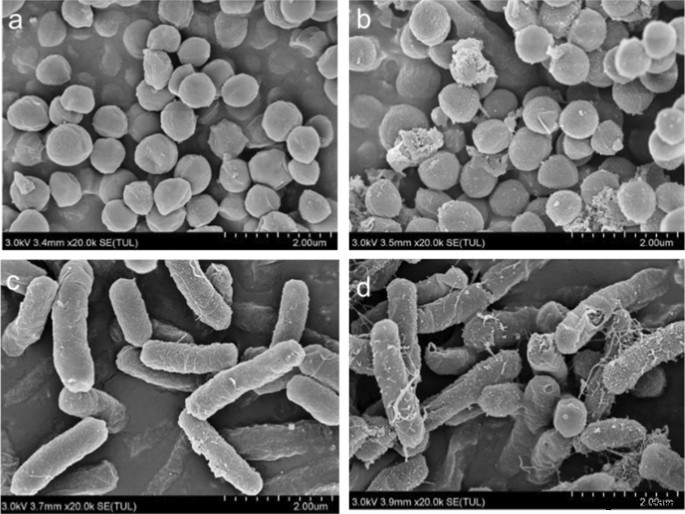
SのSEM。アウレウス ( a 、 b )および E.coli 前( a 、 c )およびその後( b 、 d )30 µg / mLのCDFによる処理。スケールバー:2 µm
CDとCDFはどちらも蛍光性であるため、消毒の進行中に細菌のイメージングのために6 µg / mLの薬剤を調査しました。 Sのイメージング。アウレウス 調査して図9に示しました。興味深いことに、CDとCDFの両方を Sのイメージングに使用できることがわかりました。アウレウス 。ただし、CDFは、明視野と暗視野から観察される細菌細胞がほぼ重なっているため、より高い取り込み効率を示します。一方、 Sの一部のみ。アウレウス 細胞はCDによって染色されました。その上、細菌細胞密度は、CDFの処理によってより小さく、CDFが消毒された Sを表す。アウレウス 同じ投与量のCDと比較してより効率的に。これらの結果は、CDFがさまざまな細菌細胞を画像化するための代替色素として使用できることも明らかにしています。
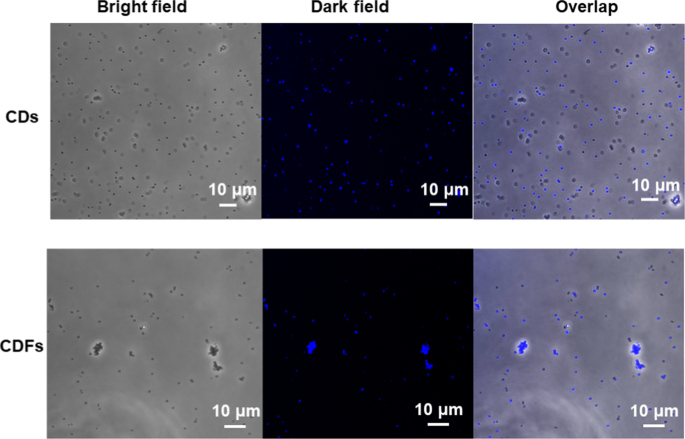
Sのイメージング。アウレウス 12時間後のCDおよびCDFの取り込みによる
結論
CDをCDFに組み立てると、より強力な抗菌活性が得られます。アセンブリ構造はより安定した特性を可能にしますが、CDの抗菌活性を拡大すると結論付けられます。この作業はまた、より実用的なアプリケーションのためのフレームワークに小さなナノ材料を組み立てる新しい道を提供します。
データと資料の可用性
この記事の結論を裏付けるすべてのデータが記事に含まれています。
略語
- CD:
-
カーボンドット
- CDF:
-
カーボンドットベースのフレームワーク
- PEI:
-
ポリエチレンイミン
- E。コリ :
-
大腸菌
- S。アウレウス :
-
黄色ブドウ球菌
- TEM:
-
透過型電子顕微鏡
- HR-TEM:
-
高分解能TEM
- XPS:
-
X線表面光電子スペクトル
- MIC:
-
最小発育阻止濃度
- NC:
-
ナノクラスター
- TCSPC:
-
時間相関単一光子カウント
- CCK-8:
-
細胞計数キット-8アッセイ
- ROS:
-
Ros活性酸素種
- SEM:
-
走査型電子顕微鏡
- ZP:
-
ゼータ電位
ナノマテリアル
- 高効率の励起に依存しない青色発光カーボンドット
- 異なる回転角のエンクロージャー内のTiO2-水ナノ流体の安定性と自然対流に関する実験的研究
- Sb /パリゴルスキー石(PAL)ナノ粒子の調製と強化された接触水素化活性
- 光触媒活性が強化されたAgナノ粒子/ BiV1-xMoxO4の相乗効果
- 異なる粒子サイズのアベルメクチンナノデリバリーシステムの製造、特性評価、および生物活性
- 垂直に整列した単層カーボンナノチューブの成長に及ぼすアルミナ支持層の強化された熱安定性の効果とナノ濾過膜におけるそれらの応用
- 強化された光触媒評価と抗菌分析のためのZnOナノ粒子に対するMgドーピングの影響
- 光熱治療のためのポリドーパミンカーボンドットの簡単なワンポット合成
- 太陽照射下での電荷分離と高い光触媒活性を強化するための部分的な表面改質を備えたZnO多孔質ナノシート
- プラズモンAg @ AgClナノ結晶を可視光触媒活性が強化されたZnCo2O4ミクロスフェアに固定
- 後処理による窒素ドープカーボンドットの表面状態誘起フォトルミネッセンス増強



