非常に効果的な標的膵臓腫瘍治療のための、血液循環が延長され、生体適合性が改善されたレスベラトロール負荷アルブミンナノ粒子
要約
ヒト血清アルブミン(HSA)は、内因性および外因性の物質を細胞膜を越えて輸送する内因性タンパク質および重要な担体です。ここでは、非常に効果的な標的膵臓腫瘍治療のために、ポリエチレングリコール(PEG)「ブリッジ」(HRP-RGD NP)を介してRGD(アルギニン-グリシン-アスパラギン酸)を結合するレスベラトロール(RV)をロードしたHSAナノ粒子を設計および準備しました。 HRP-RGD NPは、平均サイズが120±2.6 nmで、分布が狭く、均一に分散した球形で、RVカプセル化効率が62.5±4.21%、最大RV放出率がpH 5.0および37°C。 RVのinvitro生体適合性は、HSAおよびPEGでコーティングした後に改善されます。共焦点蛍光画像は、HRP-RGD NPが47.3±4.6%の最高の細胞取り込み率を示し、HRP NPおよびHRP-RGD NPと比較して、RGDを介した効果があります。セルカウンティングキット-8(CCK-8)アッセイは、RVを含まないHRP-RGD NP(HP-RGD NP)には細胞毒性がほとんどないことを示していますが、HRP-RGD NPは、遊離RVおよびアポトーシス形態を示す、濃度依存的な方法でのHRPNP。さらに、配合されたPEGおよびHSAコーティングにより、HRP-RGD NPはRVの血液循環を延長し、約5.43倍に増加します(t 1/2 )。担癌マウスへの静脈内注射後、腫瘍組織中のHRP-RGD NPの含有量は、HRPNPおよび遊離RVの含有量よりもそれぞれ約3.01倍および8.1倍高いことが証明されました。これらの結果に基づいて、HRP-RGD NPは、in vivo抗がん研究で使用され、35日間の治療で再発がなく、in vivo生体適合性が高く、全身毒性がない、すべての試験薬の中で最高の腫瘍増殖抑制効果を示しました。これらの結果は、血液循環が延長され、生体適合性が改善されたHRP-RGD NPが高い抗癌効果を示し、癌治療における将来の応用が期待できることを示しています。
背景
膵臓がんは、生存期間の中央値が6か月未満で、5年生存率が6%しかない壊滅的な疾患です[1]。膵臓がんの伝統的な臨床治療は、外科的切除、放射線療法、および化学療法です[2、3]。しかし、これらの方法は、不完全な切除後の癌細胞の拡散、放射線療法中の正常細胞への深刻な毒性、生存率の低さなどの深刻な副作用によって制限される可能性があります[4]。低い標的効果と高い副作用も化学療法における抗癌剤の有用性を制限しているが、ますます新しい化学療法剤が開発されている。合成薬とは別に、多くの中国のハーブ抽出物は特定の種類の癌に対して効果的であることがわかっています。ブドウや大豆などの植物からの天然抽出物であるレスベラトロール(RV)[5]は、血小板の凝集と血管拡張の抑制、および血液粘度の低下に広く作用しています[6、7]。また、ここ数十年で、肝臓がん、乳がん、卵巣がんなどの一部のがんに大きな抗がん効果があることもわかっています[8、9]。ただし、RVを潜在的な抗がん剤として利用することには、溶解性の低さ、血液循環の低下、選択性の欠如など、さらなる臨床応用にはいくつかの欠点があります[4、10]。
薬物の構造的完全性を保護するという前提の下で、カプセル化戦略は多くの研究者の関心を集めており、従来の「無料」薬物と比較して上記の欠点のいくつかを克服するのに効果的であることが実証されています[11]。例えば、それは溶解性の低さとバイオアベイラビリティの低さを改善し、腎クリアランスを速くし、細胞の選択性を高めることができます[12]。現在、リポソーム、ポリマーベースのナノ粒子、ヒドロゲル、血清アルブミンなどの多くのカプセル化方法が使用されています[13、14、15、16]。これらの方法の中で、血清アルブミンの使用は、不溶性の抗がん剤を送達するための最も刺激的な担体の1つになっています。内因性タンパク質であるヒト血清アルブミン(HSA)は、毒性がなく、免疫原性がなく、生体適合性が高い[17]。ドラッグデリバリー用の高分子タンパク質担体として広く使用されています[18]。したがって、HSAは親油性薬物の溶解度を向上させることができます。さらに、表面に官能性のカルボキシル基とアミノ基が存在すると、アルブミンナノ粒子の表面の官能化が促進されます[19、20]。たとえば、共有結合を介して、アルブミンナノ粒子の表面を蛍光色素、標的分子、および機能性RNAで修飾することができます[21、22]。また、PEGなどの親水性ポリマーで容易に機能化して血液循環を延長することもできます[23]。
この研究では、HSAを使用して、親油性RVを、PEG「ブリッジ」(HRP-RGD NP)を介して腫瘍標的分子であるアルギニン-グリシン-アスパラギン酸(RGD)で表面機能化されたナノドラッグとしてカプセル化します。調製されたHRP-RGDNPは、invitroおよびinvivoでの優れた生体適合性、および血液循環の延長を示します。細胞の取り込みとinvivoでの腫瘍の生体内分布も評価して、PANC-1細胞におけるその標的化の可能性を検証しました。さらに、HRP-RGDNPの標的となる抗がん効果をinvitroおよびinvivoで調査しました。これらの結果は、HRP-RGD NPが、標的化学療法アプリケーションの潜在的な腫瘍治療薬の用途の広いナノプラットフォームである可能性があることを示しています。
メソッド
資料
ヒト血清アルブミン(HSA、凍結乾燥粉末、≥96%)、レスベラトロール(RV、≥99%)、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)、フルオレセインイソチオシアネート(FITC)、Arg–Gly–Asp (RGD、≥97%)、3-(2-ピリジルジチオ)プロピオン酸 N -ヒドロキシスクシンイミドエステル(SPDP)、Hoechst 33258色素、および4 '、6-ジアミジノ-2-フェニルインドール(DAPI)は、Sigma Aldrich(セントルイス、ミズーリ州、米国)から入手しました。 NH 2 –PEG 2000 –COOHは、Seebio Biotech Inc.(上海、中国)から購入しました。 N -スクシンイミジル S -アセチルチオアセテート(SATA)は、Pierce Biotech Inc.(Rockford、IL、USA)から購入しました。 DMSO、トリプシン-EDTA溶液、リン酸緩衝液(PBS)、ウシ胎児血清(FBS)、ペニシリン-ストレプトマイシン溶液、およびDMEM培地はSigmaから購入しました。
HSA–RVナノ粒子の合成
HSA-RVナノ粒子は、単純な脱溶媒和法によって合成されました[24]。詳細には、6mgのRVをDMSOに溶解して1mg / mLにし、わずかに攪拌しながら1mLの水中で10mgのHSAと混合し、室温で6時間攪拌した後、硬化したコアセルベートを形成し、次にクロス処理しました。 -0.5%グルタルアルデヒド(100μL)との結合。その後、水中で1日間透析することにより有機溶媒を除去し、HSA-RVナノ粒子を生成しました。ブランクのHSAナノ粒子は、RVを含まないDMSOをHSA溶液と6時間混合したことを除いて、上記のように調製しました。
HRP–RGDNPの合成と特性評価
HSA–RVナノ粒子は、文献[25]に記載されているように、従来の架橋剤SPDPによってHS–PEG–RGDと結合しました。簡単に言うと、20 mg NH 2 –PEG 2000 –COOHを2mg SATAで3時間処理し、脱塩によって精製しました。得られたSATA-PEGを10mgRGDペプチドと8mgEDCに3時間添加しました。次に、SATAで保護されたPEG-RGDを、リン酸ナトリウム中の1mLのヒドロキシルアミンと3時間反応させました。脱塩により精製した後、HS–PEG–RGDを投与しました。次に、得られたHS–PEG–RGDは、ジスルフィド結合を介してHSA–RVナノ粒子と結合しました。簡単に説明すると、HSA-RVナノ粒子のアミノ基は最初にSPDPによって活性化され、次に10 mL PBSに再懸濁され、過剰なHS-PEG-RGDまたはHS-PEGと24時間反応しました。得られた溶液をPBSで繰り返し洗浄し、ミリポアフィルター(100 kDa)でろ過して、残っているPEG-RGDおよびその他の有機溶媒をすべて除去し、HRP-RGDNPを生成しました。ナノ粒子の形態とサイズは、走査型電子顕微鏡(SEM、Philips XL-30 FEG、アイントホーフェン、オランダ)とZetasizer Nano ZSシステム(Malvern Instruments、Malvern、英国)によってそれぞれ検出されました。吸収スペクトルは、UV-Vis分光光度計(UV1800、島津製作所、日本)によって取得されました。蛍光スペクトルは、蛍光分光計(F-4500、日立、日本)によって記録されました。
薬物のロードとリリース
6ミリグラムのRVをDMSOに溶解して1mg / mLにし、わずかに攪拌しながら1mLの水中で10mgのHSAと混合し、室温で6時間攪拌した後、硬化したコアセルベートを形成し、架橋によって処理しました。 0.5%グルタルアルデヒド(100μL)を使用。その後、水中で1日間透析することにより、有機溶媒と遊離RVを除去しました。透析液を使用して、検量線に従って306nmのUV-Vis分光計で遊離RVを定量化しました。 HRP-RGD NPに含まれる薬物の量は、追加されたRVの合計から遊離RVの量を差し引いたものです。
HRP-RGD NPからのRV放出は、動的透析技術(カットオフMwが8〜12 kDaの透析バッグ)を介して、37°CでそれぞれpH 5.0、7.4、および9.0PBSで検出されました。薬物濃度は、標準の検量線を使用して計算されました。カプセル化効率= W 1 / W 2 ×100%、ここで W 1 HRP-RGD NPのRVの重みを表し、 W 2 追加されたRVの重量です。累積リリース= W a / W b ×100%、ここで W a 放出されたRVの量を表し、 W b は、HRP-RGDNPに存在するRVの合計です。
インビトロ溶血アッセイ
以前の研究[26]に記載されているようにinvitro溶血アッセイを実施した。詳細には、0.2 mLの赤血球(RBC、PBS中)を0.8 mLのHRP-RGD NP(PBS中)と所定の濃度(10、50、100、および200μg/ mL)で混合しました。脱イオン水またはPBSとインキュベートしたRBCを、それぞれ陽性または陰性対照として設定しました。 37°Cで3時間インキュベートした後、上記の懸濁液のセットを10,000 rpmで1分間遠心分離し、541nmでの上清の吸光度をUV-Vis分光計でモニターしました。溶血比=(OD t − OD nc )/(OD pc − OD nc )×100%、ここでOD t 、OD pc 、およびOD nc は、テストサンプルの上清、それぞれポジティブコントロールとネガティブコントロールの吸光度です。
細胞培養
ヒト膵臓腫瘍PANC-1細胞は、中国科学院のタイプカルチャーコレクションのセルバンク(上海、中国)から購入し、加湿インキュベーター(5%)で10%FBSおよび1%ペニシリン-ストレプトマイシンを添加したDMEM培地で培養しました。 CO 2 )37°Cで。
セルラー取り込み
細胞への取り込みについては、FITCを使用してHRP-RGDNPにラベルを付けました。 PANC-1細胞は、6ウェルプレートのスライドガラスに接着し、HRP NP、HRP-RGD NP +フリーRGDブロッキング、およびHRP-RGDNPと同じ濃度の標識FITCでそれぞれ5時間インキュベートしました。次に、細胞をPBSで3回洗浄し、0.2 mLのグルタルアルデヒドで固定した後、DAPIで10分間染色しました。細胞の蛍光画像は、レーザー走査型共焦点顕微鏡(Leica TCS SP8 CARS、ドイツ、ウェッツラー)で撮影されました。
さらに、フローサイトメトリー(FCM、FACSCalibur、FACSCanto II)を使用して、PNAC-1細胞による同じ濃度の標識FITCでのHRP NP、HRP–RGD NP +遊離RGDブロッキング、およびHRP–RGDNPの取り込み率を分析しました。 FITC蛍光の測定を通じて。 FCM分析ごとに1万個の細胞が記録されました。 FITC蛍光は、488nmレーザーを使用して励起されました。
インビトロ細胞毒性
RVのキャリアであるHP-RGDNPの細胞毒性は、標準的な細胞計数キット-8(CCK-8)アッセイ(Bestbio、中国)を使用して実施しました。 PNAC-1セル(1×10 5 細胞/mL、0.5 mL)を96ウェルプレートに播種し、24時間培養しました。古い培地を廃棄した後、10、50、100、および200μg/ mLのHRP-RGDNPを含む新しい培地をPNAC-1細胞と24時間インキュベートしました。 PBSを使用して細胞を3回穏やかに洗浄した。次に、100μLのCCK-8ワーキング溶液(10%CCK-8 + 90%DMEM)を各ウェルに添加し、37°Cで0.5時間インキュベートしました。マイクロプレートリーダー(Infinite 200 Pro、Tecan、オーストリア)を使用して、450nmでの吸光度値を検出しました。さらに、PNAC-1細胞に対する同じRV濃度のRV(DMSOに溶解)、HRP NP、およびHRP-RGDNPのinvitro抗がん効果を、上記のCCK-8アッセイによって評価しました。すべての実験は4回実施されました。さらに、アポトーシスの形態学的検査は、ヘキスト33258染色によって検出されました。細胞内のHoechst33258の蛍光は、レーザー走査型共焦点顕微鏡によって観察および記録されました。
動物モデル
Balb / cヌードマウスは4〜5週間、Shanghai Slac Laboratory Animal Co. Ltd.(上海、中国)から購入しました。すべての動物実験は、実験動物の管理と使用に関するガイドに従って実施され、山東医科大学の実験動物管理局によって承認されました。皮下腫瘍異種移植モデルは、1×10 6 を注射することにより、マウスの右後部領域に確立されました。 マウスあたりPNAC-1細胞、および腫瘍が約80 mm 3 の体積を示した場合 、これらのマウスはランダムに異なるグループに分けられました( n =5)さらに使用します。
血液循環と腫瘍生体内分布
正常なマウスには、RV、HRP NP、およびHRP-RGDNPを静脈内注射しました。その後、眼窩神経叢から異なる時間に血液サンプルを採取した。各血液サンプルを900μLの溶解バッファーに溶解しました。血液中のRV、HRP NP、およびHRP-RGD NPの濃度は、UV-Vis分光計による各可溶化血液サンプルのRV吸光度スペクトルによって決定されました。サンプル濃度は、組織1グラムあたりの注入量のパーセンテージ(ID%/ g)として定義されます。
腫瘍における生体内分布は、担癌マウスで実施された。 RV、HRP NP、およびHRP-RGD NPの静脈内注射の24時間後に、腫瘍組織の重さを量り、王水溶液で一晩消化しました。腫瘍内のRV、HRP NP、およびHRP-RGD NPの濃度は、UV-Vis分光計による各可溶化腫瘍組織のRV吸光度スペクトルによって決定されました。サンプル濃度は、組織1グラムあたりの注入量のパーセンテージ(ID%/ g)として定義されます。
InVivo抗がん効果
異なるグループのマウスに、生理食塩水、RV、HRP NP、およびHRP-RGD NP(RVに等しい用量、 n )を静脈内注射しました。 =5、10 mg / kg)。治療中、担癌マウスの腫瘍サイズと体重を3日ごとに監視しました。腫瘍体積は、式 V を使用して計算されました。 =(長さ×幅 2 )/ 2。相対腫瘍体積= V / V 0 、ここで V 0 最初の治療前の腫瘍体積でした。
組織学的検査
さまざまなグループの健康なBalb / cヌードマウスに、生理食塩水(コントロール)、RV、HRP NP、およびHRP-RGD NP(RVに等しい用量、 n )を静脈内注射しました。 =5、5 mg / kg)。 35日後、マウスを犠牲にし、心臓、肝臓、脾臓、肺、腎臓を採取しました。得られた主要臓器を4%パラホルムアルデヒドで一晩固定した。その後、これらの臓器を25%ショ糖で脱水し、5 µmのスライスに切断し、ヘマトキシリンおよびエオシン(H&E)で染色しました。染色された切片は、逆位相差顕微鏡で画像化されました。
結果と考察
HRP–RGDNPの合成と特性評価
単純な脱溶媒和法[24]によれば、RVはHSAによってカプセル化され、HSA-RVナノ粒子が生成されました。その後、HSA–RVナノ粒子の表面は、従来の架橋剤SPDP [25]によってHS–PEG–RGDで共有結合的に官能化され、ナノコンポジットHRP–RGDNPを形成しました。 HRP NPおよびHRP–RGD NPは、単峰性で狭い粒度分布を示しました(図1a、b)。 HRP NPの表面にRGDを結合させた後、ナノ粒子の平均サイズは113±3.1nmから120±2.6nmに増加しました。さらに、HRP NPおよびHRP–RGD NPは、均一分散の球形の形態を示しました(図1c、d)。
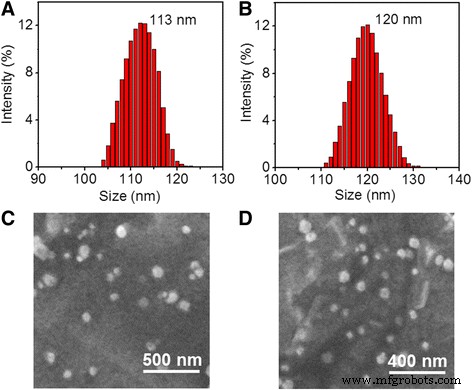
HRP NPの粒度分布( a )およびHRP–RGD NP( b )。 HRP NPのSEM画像( c )およびHRP–RGD NP( d )
UV-Visおよび蛍光スペクトルを取得して、HRP-RGDNPにRVが存在することを確認しました。図2aに示すように、HRP NPとHRP-RGD NPは、304 nmでのRVの吸光度ピークを特徴としており、両方のナノ粒子にRVが存在することを示しています。さらに、HRP NPおよびHRP–RGD NPは、325 nmの励起波長でRV蛍光シグナルを示しました。これは、RVの蛍光スペクトルと一致しています(図2b)。これらの結果は、RVがHRP NPおよびHRP–RGDNPに結合した後もその光学特性を保持していることを示しています。
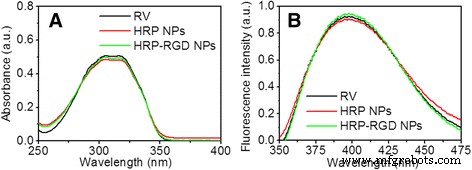
a 遊離RV、HRP NP、およびHRP–RGDNPの吸光度スペクトル。 b 遊離RV、HRP NP、およびHRP–RGDNPの蛍光スペクトル
RVのロードとリリース
図3aは、RV濃度を上げたときのHRP-RGDNPにおけるRVのカプセル化効率の変化曲線を示しています。得られたHRP-RGDNPの最大RVEEは62.5±4.21%でした。さらに、図3bに示すように、HRP-RGD NPは、pH 6.5、pH 7.4、 37°CでpH9.0。腫瘍組織がわずかに酸性であるのに対し、正常な血液pHは7.4であると報告されています[27]。これは、腫瘍治療にHRP-RGDNPを使用することの有益な機能であることが証明されています。
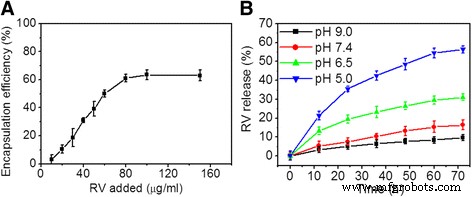
a 追加されたRV濃度の関数としてのRVカプセル化効率。 b 37°CでのpH5.0、6.5、7.4、および9.0でのHRP-RGDNPからのRVのinvitro放出プロファイル
インビトロ生体適合性
図4a、bは、7日後の4°CでのPBS中のDMSO溶解RVおよびHRP-RGDNPの画像を示しています。前者は針状結晶のような固形物を示し、後者は多くのマイクロおよびホモ分散球状粒子を含み、HSAナノ粒子によるカプセル化後のRVの安定性が向上していることを示しています。さらに、水、DMEM、PBS、およびFBSでのHRP-RGD NPの平均サイズは、4週間にわたってほとんど変化を示さず(図4c)、HRP-RGD NPの高いコロイド安定性を示しており、おそらくPEGおよびHSAカプセル化。
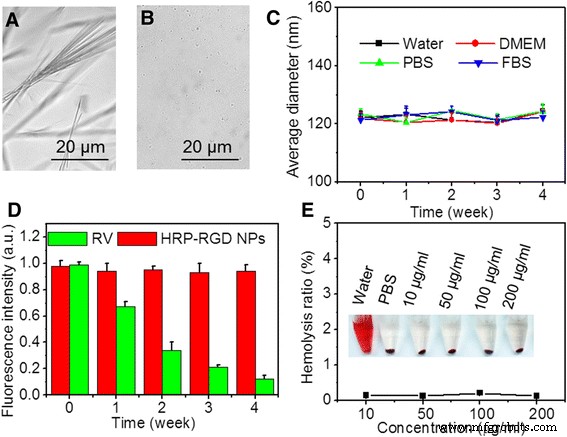
a の顕微鏡画像 PBSおよび b に溶解した遊離RV(DMSOに溶解) 7日後のPBS中のHRP-RGDNP。 c さまざまな培地(水、DMEM、PBS、およびFBS)でのHRP-RGDNPのコロイド安定性試験。 d 4週間後のHRP-RGDNPのRV蛍光安定性。 e さまざまな濃度のHRP-RGDNPと1時間インキュベートした後のRBCの溶血率。 挿入図 は、蒸留水、PBS、およびHRP-RGDNPにさまざまな濃度で曝露した後に遠心分離したRBCの写真を示しています
図4dは、4°Cの水溶液中でのRVおよびHRP-RGDNPの蛍光安定性を示しています。 4週間の保管後、HRP-RGD NPのRV蛍光強度は初期強度の96.8%以上を維持しました。ただし、RVの蛍光は初期強度の12.1%まで急速に低下しました。これは、おそらく溶液からのRVの沈殿が原因であり[10]、遊離RVと比較したHRP-RGDNPの安定性をさらに示しています。さらに、図4eに示すように、200μg/ mL未満のHRP-RGDNPで処理したRBCでは、ネガティブコントロールのPBS処理グループと同様に、有意な溶血現象は検出されませんでした。これは、HRP-RGDNPの優れた血液適合性を示しています。 。これらの結果は、HSAカプセル化がRVの安定性とin vitro生体適合性を改善したことを示唆しており、これは生物医学的用途に有益です。
セルラー取り込み
HRP NPおよびHRP–RGDNPはFITCによってラベル付けされました。図5aに示すように、核は青色の蛍光を示し、DAPIによって染色されました。 HRP-RGD NPで処理したPANC-1細胞の核周辺領域で強い緑色の蛍光(FITCシグナル)が観察され、十分な量のHRP-RGDNPが細胞質に入ったことを示しています。対照的に、HRPNPで処理したPANC-1細胞では緑色の蛍光はほとんど見られませんでした。さらに、遊離RGDで前処理されたPANC-1細胞も穏やかな緑色の蛍光を示しました。これは、PANC-1表面のRGD受容体が遊離RGDによってブロックされているためと考えられます。ナノ粒子の細胞取り込み率はFCMによって検出され、HRP NP、RGDブロッキングを伴うHRP-RGD NP、およびHRP-RGD NPで処理されたPANC-で16.2±4.9%、7.1±5.1%、および58.5±3.5%でした。それぞれ1セル(図5b)。これらの結果は、標的分子RGDがPANC-1細胞によるHRP-RGD NPの高効率的な取り込みを促進できることを示しています[28、29]。
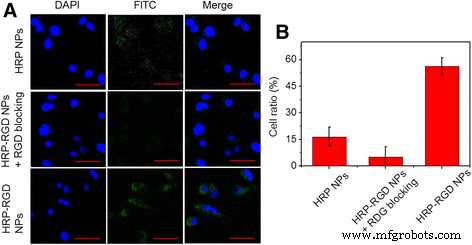
a HRP NP、RGDブロッキングを使用したHRP-RGD NP、およびFITCで標識されたHRP-RGDNPとのインキュベーション後のPANC-1細胞の共焦点蛍光画像。 緑 および青色 それぞれ、FITC蛍光およびDAPI染色細胞核を表します。 スケールバー =20μm。 b フローサイトメトリーによる、HRP NP、RGDブロッキングを伴うHRP-RGD NP、およびHRP-RGDNPに対するPANC-1細胞の定量的細胞取り込み
インビトロ細胞毒性
図6aは、PANC-1細胞の生存率が90%を超えて維持された、CCK-8アッセイによる0〜200μg / mLの濃度範囲のHP-RGDNPの細胞毒性を示しています。 200μg/ mL未満のRVキャリアHP-RGDNPのレベルには、有意な細胞毒性がないことが示唆されました。さらに、invitroでのHRP-RGDNPの抗がん効果も評価されました。図6bは、0〜50μg / mLの範囲のRV濃度での遊離RV、HRP NP、およびHRP-RGD NPが、用量依存的に細胞生存率の低下を誘発したことを示しています。遊離RVおよびHRPNPと比較した場合、HRP-RGD NPは、PANC-1細胞に対するHRP-RGD NPの安定性およびRGDターゲティング効果が原因で、すべての試験濃度で細胞生存率を最大に低下させる可能性があります[30、31]。 。さらに、遊離RV、HRP NP、およびHRP-RGD NP(すべて30μg/ mLRV)で処理されたPANC-1細胞の核は、Hoechst 33258で染色され、共焦点蛍光顕微鏡で観察されました。 HRPNPsおよびHRP-RGDNPsで処理された細胞は、RVで処理された細胞と一致する核濃縮核の存在を示し(図6c–f)、細胞死のタイプがアポトーシスである可能性が最も高いことを示しています[32]。
>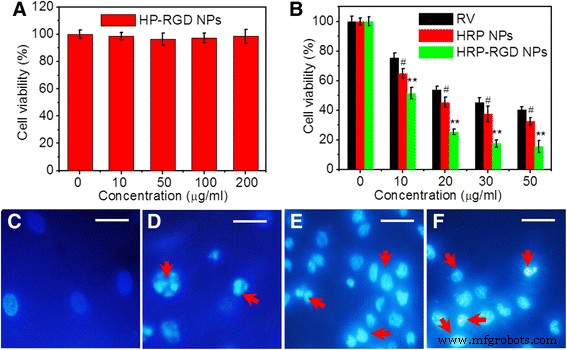
a HP-RGDNPで24時間処理した後のPANC-1細胞の細胞生存率。 b 異なる濃度のRV、HRP NP、およびHRP-RGDNPとのインキュベーション後のPANC-1細胞の細胞生存率。 PBSで処理されたPANC-1細胞の核( c )、RV( d )、HRP NP( e )、HRP–RGD NP( f )24時間の処理後、Hoechst33258で染色されました。画像はデジタルカメラを使用して記録されました。 スケールバー =20μm。 赤い矢印 核濃縮細胞を表す
血液循環と腫瘍生体内分布
図7aは、マウスに静脈内注射した後の遊離RV、HRP NP、およびHRP-RGDNPの血液循環時間を示しています。 HRP NPとHRP–RGD NPの半減期はほぼ同じであることがわかります( t 1/2 )7.5±0.5hおよび t 1/2 =6.57±0.9h、それぞれ。遊離RVは血液循環系からすぐに取り除かれ、 t 1/2 =1.21±0.09時間。 HRP-RGD NPは、RVの血液循環時間を延長し、約5.43倍に増加しました( t 1/2 )。さらに、ナノ粒子の注射後24時間で、HRP-RGD NPs治療群の腫瘍組織におけるRVの含有量は、HRPNPsおよび遊離RV治療群のそれよりも約3.01倍および8.1倍高かった。 、それぞれ(図7b)。これらの結果は、HSAおよびPEGカプセル化が循環時間を延長して、RVの除去を減少させ、腫瘍組織で有意な選択的蓄積性能を示す可能性があることを示しています[33、34]。効果[35]。
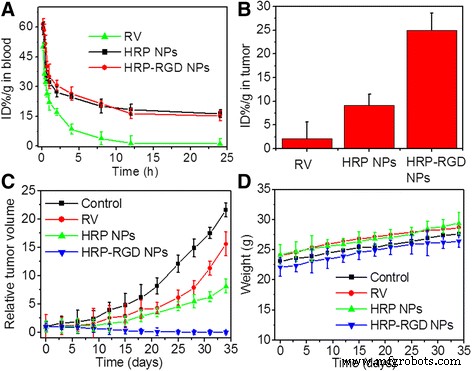
a 静脈内注射後のマウスにおける遊離RV、HRP NP、およびHRP-RGD NPの血液循環曲線は、希釈された組織溶解物からのRV吸光度によって決定されます。 b RV、HRP NP、およびHRP-RGDNPによる治療後24時間の腫瘍におけるRVの含有量。 c 生理食塩水(コントロール)、RV、HRP NP、およびHRP-RGDNPを静脈内注射した後の担癌マウスの相対的な腫瘍体積。 d 生理食塩水(コントロール)、RV、HRP NP、およびHRP–RGDNPの静脈内注射後の担癌マウスの体重
InVivo抗がん効果
図7cは、静脈内尾部注射後の同じ濃度のRVでの遊離RV、HRP NP、およびHRP-RGDNPの抗がん効果を示しています。対照として、マウスを生理食塩水で処理した。 HRP-RGD NPで治療したマウスは、腫瘍の成長が大幅に抑制され、35日間の治療後に再発することはありませんでした。遊離RVである一方で、HRP NP治療群は、対照群と同様に、腫瘍増殖の増加を示しました。予想どおり、すべてのグループのマウスの体重は、35日間の治療で有意に減少しませんでした(図7d)。さらに、生体内の全身毒性は、35日間の治療後の主要臓器(心臓、肝臓、脾臓、肺、腎臓)のH&E染色によってさらに評価されました(図8)。すべてのテストグループの対応する組織H&E染色画像には、顕著な組織毒性や異常は見られませんでした。これにより、生物医学的用途におけるHRP-RGDNPのinvivoでの安全性がさらに保証されました。
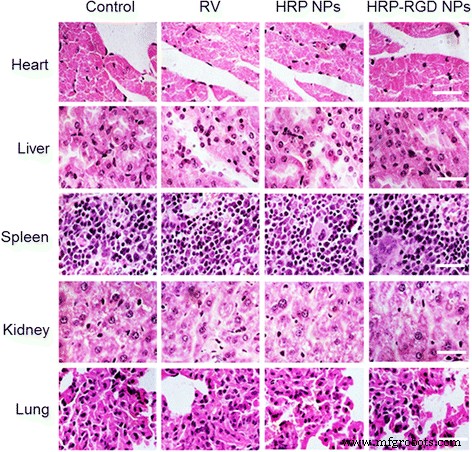
心臓、肝臓、脾臓、腎臓、および肺の代表的なHE染色画像。 スケールバー =100μm
結論
要約すると、HRP-RGDNPを非常に効果的な膵臓腫瘍標的治療薬としてどのように使用できるかを説明しました。 HRP-RGD NPは、遊離RVと比較して、invitroでコロイド安定性と生体適合性の改善を示すことが実証されました。標的分子としてのRGDは、HRP-RGDNPの非常に効率的な細胞取り込みを促進しました。 PEGとHSAの存在により、HRP-RGD NPは、遊離RVの短い血液循環を克服できる大幅に延長された循環時間を示しました。 RGDターゲティングに基づくと、腫瘍組織のHRP-RGD NPの含有量は、遊離RVおよびHRPNPの含有量よりも多かった。さらに、invitroおよびinvivoの研究では、遊離のRVおよびHRP NPと比較して、HRP-RGDNPはアポトーシスによって誘発される可能性が高い優れた抗がん効果を特徴としていることが示されました。最後に、HRP-RGD NPは、35日間の治療で、生体適合性が高く、invivoでの重大な全身毒性は見られませんでした。これらの結果は、HRP-RGDNPが将来の生物医学的応用において有望な腫瘍化学療法剤になる可能性があることを示しています。
略語
- CCK-8:
-
細胞計数キット-8
- FBS:
-
ウシ胎児血清
- FITC:
-
フルオレセインイソチオシアネート
- HSA:
-
ヒト血清アルブミン
- PBS:
-
リン酸緩衝液
- PEG:
-
ポリエチレングリコール
- RGD:
-
アルギニン-グリシン-アスパラギン酸
- RV:
-
レスベラトロール
ナノマテリアル
- 改善された診断および治療用途のための多機能金ナノ粒子:レビュー
- 癌治療のためのナノ粒子:現在の進歩と課題
- 炭化水素中の金ナノ粒子のサイズ制御と安定化のための分散剤としての修飾ハイパーブランチポリグリセロール
- 光熱治療および光音響イメージングのためのポリピロール被覆鉄-白金ナノ粒子の合成およびinvitro性能
- 腫瘍の光検出および治療のための5-アミノレブリン酸-スクアレンナノアセンブリ:invitro研究
- Auナノ粒子で調整されたシリカ珪藻殻により、生物学、安全、環境アプリケーション向けの分子の高感度分析が可能になります
- リガンドを含まないイリジウムナノ粒子の容易な合成とそれらのinvitro生体適合性
- 高効率腫瘍標的光化学療法剤としてのアルテスナート負荷および近赤外色素結合アルブミンナノ粒子
- 標的化送達のためのpH(低)挿入ペプチド(pHLIP)によるナノベシクルの装飾
- Fe3 +イオンの高効率検出のためのAgナノ粒子を備えた十分に整列したTiO2ナノチューブアレイ
- 妊娠中の二酸化チタンナノ粒子への曝露は、母体の腸内細菌叢を変化させ、ラットの血糖値を上昇させた



