ラットにおける腹腔内および静脈内投与経路による生合成された銅および酸化亜鉛ナノ粒子の比較invivo精査
要約
現在、銅(Cu)および酸化亜鉛(ZnO)ナノ粒子(NP)の抗菌機能は、病原性微生物の増殖に対抗するために広く使用されています。 CuNPsとZnONPsは化粧品、医薬品、食品添加物に繰り返し使用されており、人間と生態系への毒性影響の可能性が非常に懸念されています。この研究では、16〜96 nmの範囲の生合成銅(Bio-CuNPs)と酸化亜鉛(Bio-ZnONPs)の運命と毒性をオスのウィスターラットで評価しました。 2つのナノ粒子のinvivo曝露は、2つの異なる投与経路、すなわち腹腔内(i / p)および静脈内(i / v)注射によって達成されます。 3つの異なる濃度、無毒性量(NOAEC)、抑制濃度(IC 50 )および総致死濃度(TLC)は、Bio-CuNPおよびBio-ZnONPについて、それぞれ6.1〜19.82μg / kgおよび11.14〜30.3μg / kgの用量範囲で、i / pおよびi / v経路の両方で評価されました。観察の14日目と28日目。これらの用量範囲は、多剤耐性病原菌に対する抗菌用量の以前の研究に基づいて考慮されています。この研究では、Bio-CuNPsとBio-ZnONPsが動物の行動、動物の質量、血液学的指標、臓器指標、肝臓、脾臓、腎臓、脳の臓器の組織病理学に及ぼす毒性作用を調査しました。 3つの異なる用量でのBio-ZnONPのi / vおよびi / p投与は死亡率を引き起こさず、体重はビヒクル対照群と比較して投与の2週目までわずかに減少したことがわかりました。 11〜16μg / kg(i / v)および24〜30μg / kg(i / p)の用量範囲では、血清クレアチニンレベル、血清ALT、血清ASTレベル、ALPに有意な変化は観察されませんでした。観察の14日目と28日目の車両対照と比較して、40.7 mg / dl、37.9 IU / L、82.4 IU / Lの正常レベルでした。これらの所見は、肝臓、腎臓、脾臓の指標および組織病理学的研究で確認されています。さらに、Bio-CuNPの濃度が9.5μg/ kgの場合に肝臓と腎臓の損傷が発生しました(IC 50 )およびi / v投与経路の場合は11.7μg/ kg(TLC)。同様に、血清ALT(67.7 mg / dl)、ASTレベル(70 IU / L)、ALP(128 IU / L)の増加も観察されました。また、体重は14日目以降、対照群よりも有意に低く、この経路で統計的に有意な差が観察されました。興味深いことに、血清中のBio-CuNPsの毒性は延長されます(28日目まで)。 i / pルートを介したBio-CuNPの効果は、コントロールと比較してかなり低かった。本研究の結果は、Bio-ZnONPがBio-CuNPと比較して腎臓および肝機能のバイオマーカー(i / vとi / pの両方)に影響を及ぼさないことを明らかにしました。
グラフの要約(図1)に示されているように、私たちの目的は、invivoプロトコルを通じてBio-CuNPsおよびBio-ZnONPsの毒性を評価することです。 Kahru and Dubourguierのレビューによると、AgNP、CuNP、およびZnONPは、微生物や藻類の成長を防ぐための殺生物剤として歴史的に使用されてきました(Kahru and Dubourguier2010)。したがって、農薬と同様に、ナノマテリアルは、人間や動物を含む非標的種に対する毒性反応を監視する必要があります。金属含有NPの偶発的な放出が非標的種に脅威を与える可能性があるかどうかをよりよく理解するには、毒性効果の評価が不可欠です。「非標的生物」は、偶発的なNPの後にNPに曝露される生物です。環境に放出します。
背景
生体の正常な生理機能には、特定の金属が必要です。過去10年以来、生物医学的用途での金属ベースのNPの使用が増加しており、NPの指数関数的な使用は、生命システムに対するNP誘発性の悪影響を低減および/または防止するための安全上の懸念を警告しています[1]。 NPの中で、CuとZnOは一般的に栄養補助食品と人体に含まれています[2、3]。 CuおよびZnONPの独自の物理化学的特性は、生理学的代謝プロセスにおける機能的応用を達成し、したがって、産業におけるそれらの商業的価値を高めます[4、5、6]。しかし、溶血、胃腸の苦痛、肝臓と腎臓の損傷などの悪影響が、CuとZnONPの過剰摂取で観察されました[7]。
特に、CuNPの吸収は、摂取、吸入、および皮膚暴露の後に容易に起こり[8、9]、胃腸管を介して有意に起こります[8、10]。 CuNPは粘膜細胞を標的とし、メタロチオネインまたはグルタチオンと結合することによって内部に保持されます[11]。主に肝臓、脳、心臓、腎臓、筋肉に保存されます。 Cuの98%が血清タンパク質であるセルロプラスミンと結合し、細胞毒性を引き起こすことが報告されています。 [12、13] .Cuは、ハーバーワイス反応[14]を介したスーパーオキシドラジカル、ヒドロキシルラジカル、および過酸化水素の触媒誘導物質であり、Cuの濃度が高いと、酸化誘導ストレスが発生する可能性があります。
溶解度に基づいて、ZnONPは金属酸化物NP内のNPの別個のグループと見なされていました[15]。亜鉛元素は人体に見られ、ZnONPは毒性が低いことが知られています[3]。しかし、過剰な亜鉛は毒性作用を誘発すると報告されています[16]。金属カチオンの放出Zn 2 ZnONPからのものは、微生物やげっ歯類でも有毒であることが証明されています[17]。 ZnO NPは、血流に到達し、臓器に悪影響を与えるために、さまざまな経路を介して侵入する可能性があります[18]。予備的な結果は、ZnONPが影響を受けた臓器系が炎症、心拍数と機能の変化、および酸化ストレスを示す可能性があることを示しました[19、20]。 [21]によると、ラットが20 nm ZnONP(2.5 mg / kg体重)を1日2回吸入すると、12時間後の肝臓と36時間後の腎臓のZn含有量が増加しました。
ナノ毒性に対する意識の高まり、鼻腔内注入[22、23]、気管内注入[24、25]および経口投与[26,27,28]、皮膚暴露[29、 30]。毒性を評価するために、静脈内(i / v)および腹腔内(i / p)投与の必要性を実行する必要があります。私たちの知る限り、静脈内および腹腔内投与に対するCuNPおよびZnONPの毒性に関する最小限の報告が利用可能です。さらに、2つのNPの毒物学的メカニズムと組織分布は、i / vおよびi / p注射後の体系的な研究がまだ行われていません。
これにより、観察の14日目と28日目に、希望する腹腔内(i / p)および静脈内(i / v)注射により、オスのウィスターラットにおける16〜96nmの範囲の生合成CuNPおよびZnONPの毒性を示しました。
メソッド
バイオCuNPとバイオZnONPの生合成
非病原性 Enterococcusfaecalis からのCuNPおよびZnONPの生物学的合成 細胞外酵素法によって適応された[31、32]。さらに、合成されたナノ粒子の形状とサイズは、電界放出型走査電子顕微鏡法(FeSEM)と透過型電子顕微鏡法(TEM)を使用して確認されました。
生体内研究
実験動物と畜産
特定の無病の12〜13週齢のオスのウィスターラットは、インドのハイデラバードにあるMahaveeraEnterprisesから購入しました。各グループの体重が160〜200 gの範囲内で動物を選択し、治療開始前に1週間順応させ、ラットの健康状態を毎日監視しました。動物は、標準的な温度条件(24±1°C)と相対湿度(55±10%)で、それぞれ12時間の明暗サイクルで飼育されました。治療中、動物はステンレス鋼メッシュの蓋を備えたケージに収容された。動物には、市販の標準ペレット飼料(VRK Nutrition Solutions、Sangli、Maharashtra、India Ltd.)を与えました。飲料水は自由に動物に供給されました。
毒性試験は、インドのカラブラギにあるLuqman College ofPharmacyで実施されました。動物の取り扱いは、GoodLaboratoryPracticeに従って実施されました。研究プロトコルは、研究所動物倫理委員会によって承認されました(承認番号:346 / CPCSEA)。
Bio-CuおよびZnONPの準備と管理
Bio-CuNPsおよびBio-ZnONPs(50 mg / ml)のストック懸濁液は、再蒸留水に一晩別々に溶解して調製し、0.22μシリンジフィルターを使用してろ過しました。ろ液は、1.25〜175μg / mlの濃度範囲の作業標準を準備するために使用されます。
動物は、ナノ粒子の種類ごとに3つの異なる濃度の3つのグループに分けられました。表1および2のように、静脈内経路用に6匹のラット/グループ(実験Aセットとしてコード化)および腹腔内経路用に6匹のラット/グループ(実験Bセットとしてコード化)を検討します。両方の実験セットでグループA > コントロール(車両蒸留水)として機能しました。
<図> <図>観察と検査の項目
臨床症状
試験中、臨床毒性および/または死亡の兆候を監視するために、治療後の観察が1日1回行われました。
飼料と水の消費量
飼料と水の消費量は、処理開始日から毎日記録され、供給量と残りの量の差から計算されました。
動物の行動と体重
注射後2日ごとに、ラットの体重を測定し、行動の変化を評価しました。
血液学的指標
標準的な伏在静脈採血技術を使用して、血液学分析のために採血しました(カリウム-メチレンジアミン四酢酸収集チューブを使用)。標準的な血液学的分析によれば、300μlの血液がラットから収集され、14日と28日目に、血小板数、ヘマトクリット値、ヘモグロビン、赤血球数、白血球数などの標準的な血液学的パラメーターが分析されました[33]。
血清の生化学パネル分析
アラニンアミノトランスフェラーゼ(ALT / GPT)、クレアチニン(CRE)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)などの血清生化学的レベルを測定するために、対照ラットと治療ラットを犠牲にし、遠心分離(3000 rpm)のために全血サンプルを収集しました。 )15分間。評価は、14日目と28日目のサンプルに対して自動生化学分析装置によって実行されました[34]。
細胞小器官の重量の検出
14日後と28日後、ラットをリン酸緩衝生理食塩水を含むエーテルで麻酔し、解剖しました。対照群と治療群の臓器は直ちに採取された。心臓、肺、胸腺、脳、腎臓、肝臓、脾臓を注意深く分離し、塩化ナトリウム溶液で洗浄し、氷冷した脱イオン水ですすぎ、濾紙で乾燥させた。解剖された臓器の形態と色を調査し、各臓器の重量を測定した。 Bio-CuおよびZnONPによって明示的に引き起こされた変化の程度を調べるために、臓器指数(O X )は、式[35]を使用して個別に計算されました:
$$ \ mathrm {Organ} \ \ mathrm {index} \ \ left({\ mathrm {O}} _ {\ mathrm {X}} \ right)=\ frac {\ mathrm {Weight} \ \ mathrm {of} \ \ mathrm {experimental} \ \ mathrm {organ} / \ mathrm {weight} \ \ mathrm {of} \ \ mathrm {experimental} \ \ mathrm {animal}} {\ mathrm {Weight} \ \ mathrm {of} \ \ mathrm {control} \ \ mathrm {organ} / \ mathrm {weight} \ \ mathrm {of} \ \ mathrm {control} \ \ mathrm {animal}} $$オルガンインデックス(O X )次のように変更される場合があります:
心係数(H X )、肝臓指数(Li X )、脾臓指数(S X )、肺指数(Lu X )、腎臓インデックス(K X )、胸腺指数(T X )、脳指数(B X 。
組織学
対照を含む各グループからの1匹のラットを、リン酸緩衝生理食塩水放血後の10%緩衝ホルマリンで固定した。肝臓、腎臓、脾臓、脳の小片を10%ホルマリンで固定し、パラフィンに包埋しました。パラフィンブロックを切片化し、ヘマトキシリンおよびエオシン染色のために処理した。染色された切片は、明視野顕微鏡を使用して観察されました[36]。
統計分析
すべてのデータは、3回の独立した実験の平均の平均±SDで表されます。それぞれが3回行われた N =グループあたり6匹のラット。
結果と考察
Bio-CuNPsおよびBio-ZnONPsの合成は、反応物を Enterococcus faecalis に曝露する際に、細胞外酵素法によって実施されました。 上澄み。 Bio-CuNPsとBio-ZnONPsのFeSEM分析は、分布が1〜100 nmの範囲のサイズで見ることができます(追加ファイル1)。 TEM分析では、CuNP [31]および16〜96 nm [32]の範囲のZnONPについて、サイズが12〜90 nmで球形のコアシェル形態を持つ生合成CuNPおよびZnONPの存在が報告されています(追加ファイル2)。
オスのウィスターラットにおけるBio-CuおよびZnONPの評価は、NP治療時に死亡の兆候なしに調査されました。さらに、治療後および実験期間の終了まで、9.5〜11.5μg / kgの投与量でBio-CuNPをi / v投与した後、白い糞便の頻繁な検査を監視しました。 3週目から4週目までの間に、Bio-CuNPsで処理されたラットは、飼料の有意な増加を示し、i / vの水消費量は9.5μg/ kgでした(IC 50 )および11.5μg/ kg(TLC)であるのに対し、i / p経路(用量範囲:24.8〜30.3μg / kg)および対照群のラットでは3〜4週目。i/ vおよびi /後のラットの体重の変動Bio-CuNPsとBio-ZnONPsのp投与は、表3と4に示されています。体重の減少と増加は、試験サンプルの毒性を評価する上で貴重な指標です[37]。 13.5nmの金[33]および100nmの銀[38]の毒性研究で証明された以前の報告では、i / v注射による体重へのNPの影響はi / pおよび経口投与よりも小さかった。 Rhiouani et al。、によると すべての治療群で4日間の治療後の体重の減少が少ないことは、動物に対する毒性物質の悪影響を示唆している可能性があります[39]。
<図> <図>3つの異なる用量(NOAEC、IC 50 )でのBio-ZnONPのi / vおよびi / p投与が見られます。 およびTLC)体重は、対照群と比較して、投与の2週目までわずかに減少した。しかし、14日後に体重が回復しました。 i / p投与の場合、体重の減少は、総致死濃度のBio-ZnONP(30.3μg/ kg)によって誘発され、対照群よりも低かったため、i / v経路を介したi / p経路による軽微な毒性を示しています。 (表4、図1a)。同様に、9.5μg/ kgおよび11.7μg/ kgの濃度でi / v経路を介してBio-CuNPsで治療されたラットは、体重のわずかな減少が認められました。 Bio-CuNPsによる14日間の治療まで、成長と体重増加に対する兆候の悪影響は観察されませんでした。 11.7μg/ kg(i / vルート)の用量で28日以内の体重変化を表3に示します。治療の14日後、コントロールと比較した場合、i / vルートを介した体重の大幅な減少が見られました。グループ。したがって、このルートを介したBio-CuNPの毒性を示します(図1b)。 i / p経路投与を介してラットを治療したBio-CuNPsは、体重のわずかな減少を誘発し、i / p経路とi / v経路の両方で死亡の兆候は観察されなかった。したがって、i / p注射はより低い毒性を誘発しました(表4および図1aに示されています)。
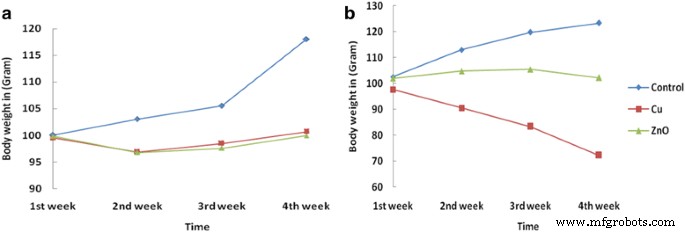
未処理(対照)およびBio-CuNPおよびBio-ZnONPで処理されたラットの体重の変化。観察の28日目までの(A)腹腔内(i / p)および(B)静脈内(i / v)投与経路で治療されたBio-CuNPおよびBio-ZnONP。総致死濃度でのBio-CuNPs(Cu)およびBio-ZnONPs(ZnO)のすべての処理が実施され、28日間観察されました。 N =グループあたり6匹のラット
血液学インデックス
RBC数、WBC数、血小板数、ヘモグロビンレベル、血液凝固時間などの血液学的パラメーターの推定は、治療されたNPの毒性を測定するための重要な要素です。 14日目と28日目の濃度依存性血液学の結果は、i / pとi / vの投与経路について表5と6に示されています。 9.5μg/ kgでのBio-CuNPの投与量(IC 50 )およびi / vルートを介した11.7μg/ kg(TLC)は、Bio-ZnONPとは対照的にRBC数の減少を示しています。ただし、濃度依存性の傾向は認められていない。 i / v投与経路でBio-ZnONPで治療されたラットでは、ヘモグロビンレベル、血小板数、および白血球が変化しましたが、3つの濃度すべて(NOAEC、IC 50 )間で有意差は観察されません。 およびTLC)。しかし、i / p投与経路の場合、対照およびバイオ-と比較して、観察の14日目に赤血球数、白血球、ヘモグロビンレベル、および血小板数の有意な減少と変化が見られました。処理されたCuNP。驚いたことに、血液学的影響は28日目には正常であることがわかりました(表6)。
<図> <図>観察の14日目と28日目の2つの異なるBio-NPに対する異なる注射方法(i / v、i / p)の血液学的効果は多様です。ヘモグロビン、赤血球、白血球、血小板は、Bio-CuNPs治療ではi / v経路を介して、Bio-ZnONPs治療ラットではi / p経路を介して減少することが観察できます。しかし、RBC数の有意な減少が観察されました。これは、異なる注射経路が、Bio-CuNPを注射されたラット(i / v経路)を除いて、血小板数、ヘモグロビン、または白血球に有意差を誘発しなかったことを示しています。赤血球は、i / pおよびi / v注射後に有意差を示します(表5および6を参照)。
血清の生化学的アッセイ
血清クレアチニンは老廃物です。より高いクレアチニン産生は腎臓の損傷を示します。 Bio-ZnONP(i / vルート:11-16μg/ kgの投与量、i / pルート:24-30μg/ kgの投与量)は、14日目と28日目のコントロールと比較して血清クレアチニンレベルに有意な影響を与えませんでした。 (表7および8、図2a、b)。 Bio-CuNPs(i / vルート:投与量06〜12μg / kg)で治療されたラットは、対照と比較した場合、血清クレアチニンレベルが2.3 mg / dlに増加することを示しました。ただし、i / p注射経路では、有意な変化は見られませんでした(表7および8)。血清には多くの酵素が含まれていますが、肝臓の正常および病理学的症状を評価するには、アラニントランスアミナーゼ(グルタミン酸ピルビン酸トランスアミナーゼ)およびアスパラギン酸トランスアミナーゼ(グルタミン酸シュウ酸酢酸トランスアミナーゼ)が有用です。アスパラギン酸トランスアミナーゼはミトコンドリア起源であり、肝臓、心臓、腎臓、骨格筋に大量に存在します。血清アルカリホスファターゼは低分子量のグロブリン酵素であり、骨、肝胆道、腎臓に高濃度で見られます。この酵素の活性は、グリセロールホスフェートから遊離した有機ホスフェートの推定によって決定することができます。酵素の血清レベルは、肝細胞性黄疸と閉塞性黄疸の両方で増加しました。 i / v投与経路では、Bio-ZnONP(40.7 mg / dl、37.9 IU / L、82.4 IU / L)は、対照と比較して、血清ALT、血清AST、およびALPレベルに有意な影響を与えませんでした。 i / p投与では、14日目と28日目に対照と比較して、ALT、AST、ALPレベルの有意な増加が見られました(図2aおよびb)。血清の毒性研究の結果は、Bio-ZnONPが28日までi / vルートのクレアチニン、ALT、AST、ALPレベルに変化がないことを示しました。
<図> <図>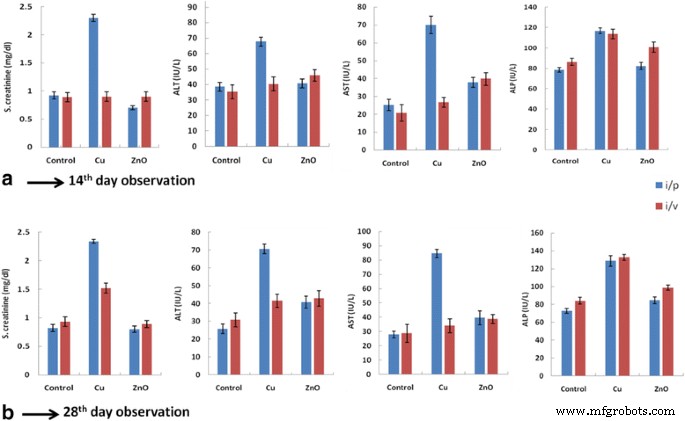
Bio-CuNPsおよびBio-ZnONPsで処理されたラットの生化学的結果。 S.クレアチニン、ALT、ASTおよびALPレベルは、(A)14日目および(B)に腹腔内(i / p)および静脈内(i / v)投与経路を介してBio-CuNPsおよびBio-ZnONPsで治療されたラットで測定されました。 28日目。すべてのデータは、3回の独立した実験の平均の平均±SDで表されます。それぞれが3回行われた N =グループあたり6匹のラット。注:Cu:Bio-CuNPs、ZnO:Bio-ZnONPs、i / p:腹腔内、i / v:静脈内
対照的に、i / v経路でBio-CuNPsで治療されたラットは、血清ALT(67.7 mg / dl)、ASTレベル(70 IU / L)、およびALP(128 IU / L)の有意な増加を示しました。 i / pルートを介したBio-CuNPの効果は、コントロールと比較してかなり低かった。結果の違いは、投与経路の違い、ナノ粒子の毒性、および投与期間に起因する可能性があります。 Bio-ZnONPは、Bio-CuNPと比較して、腎臓および肝機能のバイオマーカー(i / vとi / pの両方)に影響を与えないことがわかりました。
細胞小器官の重量の検出と組織学的研究
異なるBio-NP用量でのラットの臓器重量の変化は、臓器に対するNPの悪影響を示しています。表9および10に示すように、Bio-ZnONPで処理すると、ラットの心臓、肝臓、脾臓、肺、腎臓、および脳の重量が減少することがわかります。さらに、臓器反応と変化の程度を考慮すると、臓器指数(O X )各臓器を個別に。心臓、肝臓、脾臓、肺、腎臓、脳、胸腺の臓器指数を表9と10に示します。
<図> <図>脾臓と胸腺の重量の違いは、Bio-CuNPsとBio-ZnONPsで処理されたラットでi / vとi / pの投与後に観察されました。 14日目に、Bio-ZnONPは、i / p注射により脾臓指数が低下し、i / v投与により増加したことを示しています(表9)。 Bio-CuNPsの場合、i / v投与によりラットを治療すると、14日目(0.265)と28日目(0.49)に脾臓指数の有意な低下が見られました。したがって、免疫系はi / vBio-CuNPs投与およびi / pBio-ZnONPs投与によって影響を受けていることを示しています。 i / p Bio-ZnONPs投与の場合、ラットの免疫系は14日後に正常な状態に再発し、効果が持続しないことを証明しています。以前の体重変動と合わせて考えると、Bio-CuNPのi / v投与経路は、心臓、肝臓、肺、腎臓、および脳に影響を与える可能性があるようです。さらに、免疫システムに損傷を与える可能性があります。図3aから、脾臓と胸腺がBio-CuNPsによる臓器の主な標的であることを意味します。
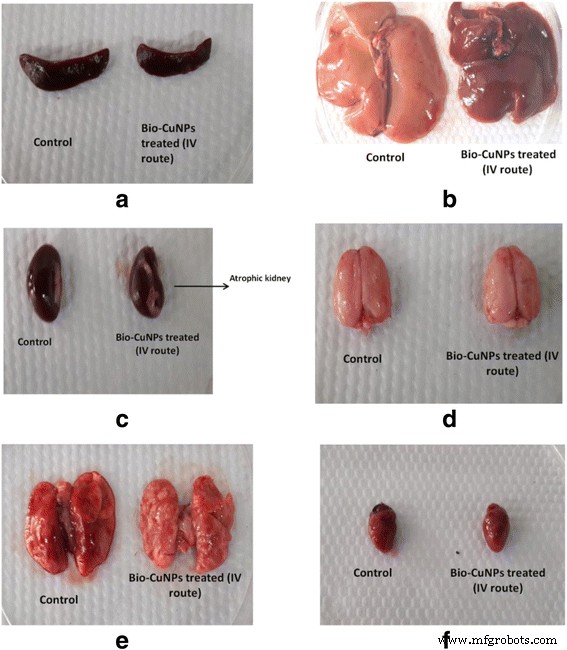
オルガネラ形態の変化。ここで a 脾臓、 b 肝臓、 c 腎臓、 d 脳、 e 肺と f 28日目の観察での対照と比較した静脈内経路を介してBio-CuNPsで治療されたオスのウィスターラットの心臓
i / vおよびi / p Bio-CuNPs治療群の場合、臓器指数への明らかな影響が両方のIC 50 で観察されています。 およびTLC用量。さらに、2つの異なる投与経路のうち、腹腔内注射は、Bio-ZnONPs治療群で中程度の毒性を示し、Bio-CuNPs治療群で最も高い毒性を示します。マウス腹膜の血管とリンパ液が密集しているため、i / p注射による効率的な薬物吸収が速いことが知られています[40]。同様に、静脈内注射は、Bio-ZnONPs治療群で最小の毒性を示し、Bio-CuNPs治療群で最高の毒性を示します。
ラットの毒性学的変化
Bio-NPのさまざまな用量と時間間隔で、毒性の影響を精査しようとしました。 Bio-ZnONP(i / v経路:投与量範囲11-16μg/ kg、i / p経路:投与量範囲24-30μg/ kg)で治療された組織は、肝臓、腎臓、脾臓、脳に変化が見られませんでした。対照組織(図4、5、6、7)。剖検観察(剖検:死んだラットの解剖検査)は、Bio-NPsで治療したラットのすべての臓器が、未治療の動物での外観に基づいて予想される解剖学的特徴(色、形、サイズの特徴など)を示したことを示しました。 Bio-ZnONPと比較して、Bio-CuNPで処理されたラットは、対照とは対照的に、腎臓、肝臓、脾臓、脳組織の解剖学的特徴に、より有意な変化を示しました(図4、5、6、7)。
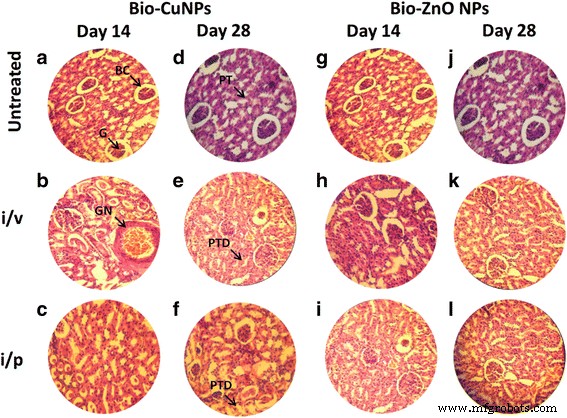
ラット腎臓のH&E染色切片。 i / vおよびi / pルートを介してBio-CuおよびZnONPで治療されたラット。未処理のサンプルをコントロールと見なしました。 14日目(A–C)と28日目(D–F)にBio-CuNPsで処理された切片が観察された場合。 14日目(G–I)と28日目(J–L)のBio-ZnONPの処理セクション。 BCボーマン嚢、G糸球体、PT近位尿細管、GN糸球体壊死、PTD近位尿細管損傷
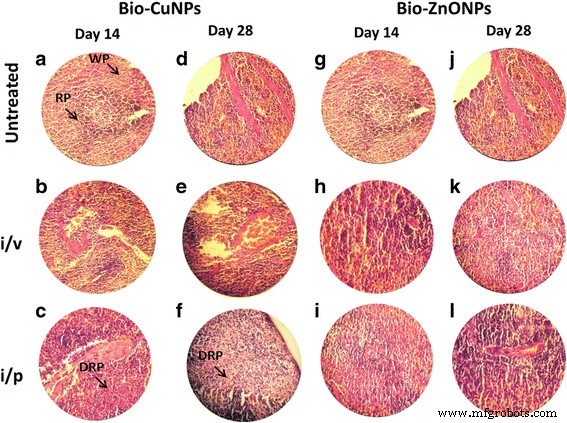
ラット脾臓のH&E染色切片。 i / vおよびi / pルートを介してBio-CuおよびZnONPで治療されたラット。未処理のサンプルをコントロールと見なしました。 14日目(A–C)と28日目(D–F)に観察されたBio-CuNPsで処理された切片。 14日目(G–I)と28日目(J–L)のBio-ZnONPの処理セクション。 WP白脾髄、RP赤脾髄、赤脾髄のDRP低下
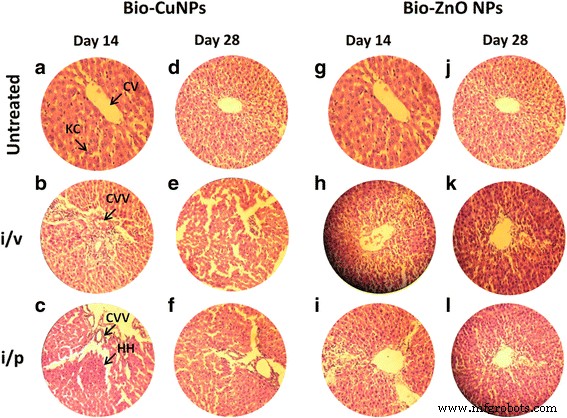
ラット肝臓のH&E染色切片。 i / vおよびi / pルートを介してBio-CuおよびZnONPで治療されたラット。未処理のサンプルをコントロールと見なしました。 14日目(A–C)と28日目(D–F)に観察されたBio-CuNPsで処理された切片。 14日目(G–I)と28日目(J–L)のBio-ZnONPの処理セクション。 CV中心静脈、KCクッパー細胞、CVV中心静脈空胞化(細胞質空胞化)、HH肝出血
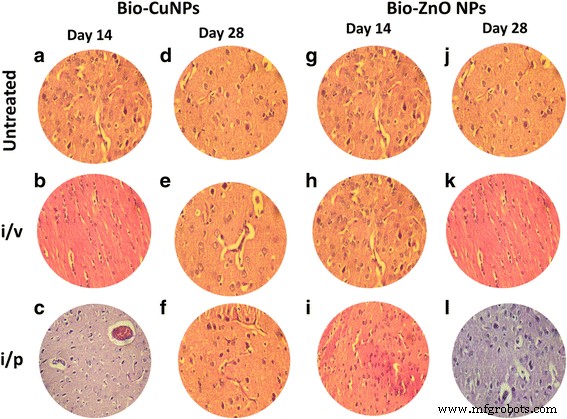
ラット脳のH&E染色切片。 i / vおよびi / pルートを介してBio-CuおよびZnONPで治療されたラット。未処理のサンプルをコントロールと見なしました。 14日目(A–C)と28日目(D–F)に観察されたBio-CuNPsで処理された切片。 14日目(G–I)と28日目(J–L)のBio-ZnONPの処理セクション。 [すべてのスライドは、倍率40倍、NIKON eclipse E200(三眼顕微鏡)で観察されます]
Bio-CuNPsは、i / v経路投与を介して損傷を誘発し、組織で用量依存的な傾向を示しました。 TLC(11.7μg/ kg)濃度では、Bio-CuNPはWistarラットの肝臓および腎臓組織に深刻な損傷を示しました。さらに、i / vルートとi / pルートの両方で処理されたBio-CuNPは、グループ14日目と28日目のラットで糸球体細胞(糸球体萎縮)、ボーマン嚢、近位尿細管の壊死を誘発しました(図4b、e、c、f )未処理のコントロールと比較した場合。糸球体壊死は免疫学的償還によるものですが、尿細管の損傷は主にNPの毒性作用によるものです。 i / vおよびi / p経路の両方を介したBio-CuNPの毒性作用によって引き起こされる尿細管損傷も、糸球体圧を上昇させ、糸球体萎縮を引き起こします。
正常な対照群は、肝小葉と正常な肝細胞に囲まれた中心静脈の正常な組織学的構造を示しました(図6)。 i / pルート(19.82μg/ kg)で処理されたBio-CuNPは、14日目と28日目の観察の両方で、クッパー細胞の活性化を含む軽度の組織学的変化を示しました(図6b、e)。 i / vルートを介してBio-CuNPsで治療されたラットは、14日目の観察で、中心静脈に囲まれた肝細胞の細胞質空胞化や肝出血などの深刻な変化を示しました(図6c)。驚いたことに、28日目のグループでは、肝細胞の脂肪変化や肝細胞核の核濃縮など、中程度の変化が見られました(図6f)。 i / pルート投与群の14日目にBio-ZnONPで処理された肝臓組織は、肝細胞の脂肪変化によって示される中程度の変化を示しました(図6i)。 Bio-ZnONPの治療群はわずかな改善を示し、14日目と比較して28日目に有意な肝保護活性が観察されました(図6l)。 14日目以降、Bio-ZnONPの治療を受けた動物で正常な肝構造の回復が起こりました。
脾臓細胞(赤脾髄)の減少と、i / v経路を介してBio-CuNPsで処理されたラットから抽出された脾臓組織のリンパ球(白脾髄)の増加が認められました(図5c、f)。一次観察では、脾臓でのBio-CuNPの蓄積が赤脾髄で認められ、細胞塊の適度な喪失と関連していた。 i / v投与の14日目と比較した場合、28日目の時点で細胞量の減少が明らかでしたが(図5f)、ラットをi / pルートでBio-CuNPsで治療した場合、赤脾髄の枯渇にわずかな変化が観察されました。 both 14th and 28th day time point. Structural changes were not seen in the white pulp or in splenic blood vessels (arteries or venous sinuses) and intravascular erythrocytes (Fig. 5b, e). No morphological changes have been found in spleen tissues treated with Bio-ZnONPs (Fig. 5). The H&E-stained brain sections of rats, treated (i/v and i/p) with NPs, showed no changes in brain region, olfactory bulb (perivascular localization) and the choroid plexus and ependyma of the lateral ventricles (Fig. 7).
Conclusion
Animal toxicity studies using 16- to 96-nm-ranged biosynthesized copper (Bio-CuNPs) and zinc oxide (Bio-ZnONPs) was assessed in male Wistar rat at the dose range of 6.1 to 19.82 μg/kg and 11.14 to 30.3 μg/kg respectively for both i/p and i/v routes on 14th and 28th day of observation. We observed no mortality and normal behaviour in the animals treated with Bio-CuNPs and Bio-ZnONPs in their specific dose range. The results also verified the Bio-CuNPs and Bio-ZnONPs at low concentrations do not cause identifiable toxicity even after their breakdown in vivo over time. Increased concentrations of these Bio-NPs induce weight reduction, but no significant statistical difference was observed for Bio-ZnONPs’ treated animals. In the case of i/v and i/p Bio-CuNPs’ treated groups, obvious effects on organ index have been observed at both IC50 and TLC doses. Moreover, of the two different administration routes, the intraperitoneal injection shows the modest toxicity in Bio-ZnONPs’ treated groups and highest toxicity in Bio-CuNPs’ treated groups. Correspondingly, the intravenous injection shows the least toxicity in Bio-ZnONPs’ treated groups and highest toxicity in Bio-CuNPs’ treated groups. Considering all the results of studies, targeting Bio-ZnONPs by intravenous injection is promising for possible biomedical application.
略語
- ±:
-
Plus or minus
- ALP:
-
アルカリホスファターゼ
- ALT:
-
Alanine aminotransferase
- AST:
-
Aspartate aminotransferase
- Bio-CuNPs:
-
Biogenic copper nanoparticles
- Bio-ZnONPs:
-
Biogenic zinc oxide nanoparticles
- BX :
-
Brain index
- CRE:
-
Creatinine
- Cu:
-
Copper
- FesEM:
-
電界放出型走査電子顕微鏡
- H&E:
-
Haematoxylin eosin
- Hb:
-
Haemoglobin
- HX :
-
Heart index
- i.e.:
-
That is
- i/p route:
-
Intraperitoneal route
- i/v route:
-
Intravenous route
- IC:
-
Inhibitory concentration
- KX :
-
Kidney index
- LiX :
-
Liver index
- LuX :
-
Lung index
- NOAEC:
-
No observable adverse effect concentration
- NP:
-
ナノ粒子
- Ox :
-
Organ index
- RBC:
-
Red blood cell
- SD:
-
標準偏差
- SX :
-
Spleen index
- TEM:
-
透過型電子顕微鏡
- TLC:
-
Total lethal concentration
- TX :
-
Thymus index
- WBC:
-
White blood cell
- ZnO:
-
酸化亜鉛
ナノマテリアル
- 生体適合性FePO4ナノ粒子:ドラッグデリバリー、RNA安定化、および機能的活性
- Escherichia coliに対する酸化銅ナノ粒子の生体合成、特性評価、および抗菌力の評価
- 非常に効果的な標的膵臓腫瘍治療のための、血液循環が延長され、生体適合性が改善されたレスベラトロール負荷アルブミンナノ粒子
- In VivoCTイメージングおよび腎クリアランス特性のための新しい生体適合性AuNanostars @PEGナノ粒子
- invitroおよびinvivoでのグラフェンおよび酸化グラフェンのバイオセーフティおよび抗菌能力
- 炭化水素中の金ナノ粒子のサイズ制御と安定化のための分散剤としての修飾ハイパーブランチポリグリセロール
- 光熱治療および光音響イメージングのためのポリピロール被覆鉄-白金ナノ粒子の合成およびinvitro性能
- 銅ナノ粒子の合成と安定化におけるグリーン熟達度:触媒、抗菌、細胞毒性、および抗酸化活性
- ラットにおける腹腔内および静脈内投与経路による生合成された銅および酸化亜鉛ナノ粒子の比較invivo精査
- 金属および金属酸化物ナノ粒子のグリーン合成と単細胞藻類Chlamydomonasreinhardtiiに対するそれらの効果
- ナノ粒子と超音波によって制御される水の過冷却



