マルチモード生分解性腫瘍-標的乳がんイメージングのための微小環境に敏感なナノ粒子
要約
ガスで満たされた超音波(US)造影剤は体内で容易に崩壊し、ガスは容易にオーバーフローする可能性があるため、USイメージングの有効性が制限されます。この問題に対処するために、MRネガティブ造影剤Fe 3 を搭載した注入可能なガス発生マルチモードシステムが開発されました。 O 4 、蛍光色素Cy5.5、およびCO 2 ドナーの放出(Na 2 CO 3 )。ナノ粒子は二酸化炭素を継続的に生成できます(CO 2 )体内の酸性腫瘍組織内のガス。超音波画像下で腫瘍に強いエコー信号を与えます。さらに、ナノ粒子は腫瘍組織のMRおよび蛍光イメージングに優れた効果をもたらします。結果は、このpH応答性NPシステムがMR / US /蛍光イメージングで優れた効果を提供することを示しています。この研究は、マルチモード腫瘍イメージングの有用なリファレンスを提供します。
はじめに
臨床現場では、マイクロバブルは主に、さまざまな臓器や血管をリアルタイムでイメージングするための超音波造影剤として使用されます[1,2,3]。従来の超音波造影剤は、通常、空気またはパーフルオロカーボンガスを封入する脂質やタンパク質などの材料で構成されています。ミクロスフェアにカプセル化されたガス種は、マイクロバブルの欠陥が急速に拡散するため、血液中での安定性が低く、半減期が短くなります[4、5、6]。さらに、ガスで満たされたマイクロバブルの粒子サイズは通常大きいため(約1〜8μm)、マイクロバブルが組織の血管外漏出によって宿主腫瘍環境に浸透することは困難です。したがって、血管内イメージングにおけるミクロンサイズの気泡の現在の用途は限られています[7]。理想的な超音波造影剤は、一般に、組織血管空間を通過するための最適なサイズ、適切な持続時間の音響効果、良好なターゲティングと生体適合性、および体からの容易な排泄を示す必要があります[8、9]。 「ガス発生ナノ粒子」の概念は以前の研究で提案されており、そのようなナノ粒子は超音波造影イメージングで使用できる可能性があります[10、11、12]。これらのガス生成ナノ粒子は、現在のガスで満たされたマイクロバブルよりも性能が優れており、連続的に生成されたガスにより、強力な超音波イメージングが可能になります。ガスを生成するナノ粒子は、浸透と保持を強化することができ、血液中を安定して循環し、腫瘍組織に効果的に蓄積する可能性があります[13、14]。
磁気共鳴画像法(MRI)、コンピューター断層撮影(CT)、超音波など、取得時間が長く、放射線量が多く、感度が低いために制限される従来の画像法で、小さくて潜在的な腫瘍を検出することは依然として課題です[15 、16]。がんの早期発見のための総合的な相乗効果を実現するには、さまざまな画像診断法を統合し、マルチモーダル画像診断技術を開発する必要があります[17、18、19]。超常磁性酸化鉄(Fe 3 O 4 )ナノ粒子は、T2強調画像でネガティブMRI造影剤として使用できます[20、21]。 Fe 3 O 4 小さな粒子サイズ、強い浸透性、高い磁化、良好な代謝、および比較的低い毒性を含む魅力的な全体的な特性を持っています[22、23]。 Fe 3 O 4 早期癌のMRI診断用の造影剤は、その高い弛緩とコントラストのために広く研究されてきました[24、25、26]。さらに、リアルタイム蛍光イメージングは優れた解像度を備えており、腫瘍の病期分類を定義し、腫瘍切除をガイドし、治療効果を監視するための貴重な方法となります[27、28]。
ここで、これらのナノ粒子は主にポリ(乳酸-コ-グリコール)酸(PLGA)によってカプセル化されており、これは食品医薬品局(FDA)によってバイオセーフ材料としての使用が承認されています[29、30]。 PLGA粒子は、RGDペプチドで修飾されて乳がん細胞表面のαvβ3インテグリンへの結合を可能にし、Cy5.5をinvivoでのイメージング用の蛍光色素として使用します。これらはFe 3 でカプセル化されています。 O 4 MRIでT2陰性造影剤として機能する(スキーム1a)。細胞外環境でより多くの乳酸とプロトンを生成する可能性のある腫瘍組織での解糖のアップレギュレーションにより、腫瘍組織のpH(6.8–7.2)は正常組織のpH(pH 7.4)よりも低くなります[31,32,33]。 。そこで、炭酸ナトリウム(Na 2 CO 3 )PLGAでCO 2 を生成します 超音波画像診断のための腫瘍組織のより低いpHでの泡。腫瘍イメージングにおけるそれらの有望なアプリケーションを検証するために、in vitroイメージング用のこれらのマルチモードナノ粒子の包括的な特性を、細胞毒性、標的特異性、腫瘍組織における生体内分布など、3つのイメージングモードによって体系的に特徴付けました。

a Fe 3 の関数の概略図 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGD NPは、腫瘍への標的化された蓄積とCO 2 の生成を介して 酸性腫瘍組織の気泡、続いて乳がんのトリプルモーダルMR / US / FIイメージング。 b Fe 3 の準備の概略図 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNP。
結果と考察
Na 2 の合成と特性評価 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NP
Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、PLGAの生体適合性ポリマーをFe 3 でカプセル化することにより、RGDをターゲットとしたマルチモード造影剤として設計されました。 O 4 およびNa 2 CO 3 生分解性化学結合を介したインテグリン標的薬剤(スキーム1b)。
透過型電子顕微鏡画像は、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは透明な球体であり、シェルに均一に分散した酸化鉄粒子が見られます(図1a)。 NPの平均流体力学的サイズは動的光散乱によって117.6nmと測定され、平均多分散度指数は0.234でした(図1b)。 NPの表面電荷は、ゼータ電位測定によって-21.7 mVであることが確認されました(図1c)。蛍光スペクトル測定により、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGDの最大発光波長は685nmであり、Cy5.5がPLGAコアに正常にカプセル化されたことを示しています(図1d)。 Na 2 の飽和磁化値 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGDおよび無料のFe 3 O 4 NPはそれぞれ32.6および42.5emu / gに等しかった(図1e)。これらの発見は、室温でのナノ粒子の超常磁性特性を示した。 Na 2 のFITRスペクトル CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGDは、N-H伸縮振動と–OH吸収ピークが3432 cm -1 付近に現れることを示しました。 。さらに、拡張機能(1628 cm -1 )が見つかりました。 )C =Oの伸縮振動。非標的NPと比較すると、1735 cm -1 に特徴的なピーク(カルボキシル)があります。 対象となるNPの割合が大幅に減少しました。結果は、ミクロスフェア表面のカルボキシル基とRGDペプチドのアミノ基との間の結合を示した。 Na 2 のinvitro結合 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGDNPを図1fに示します。
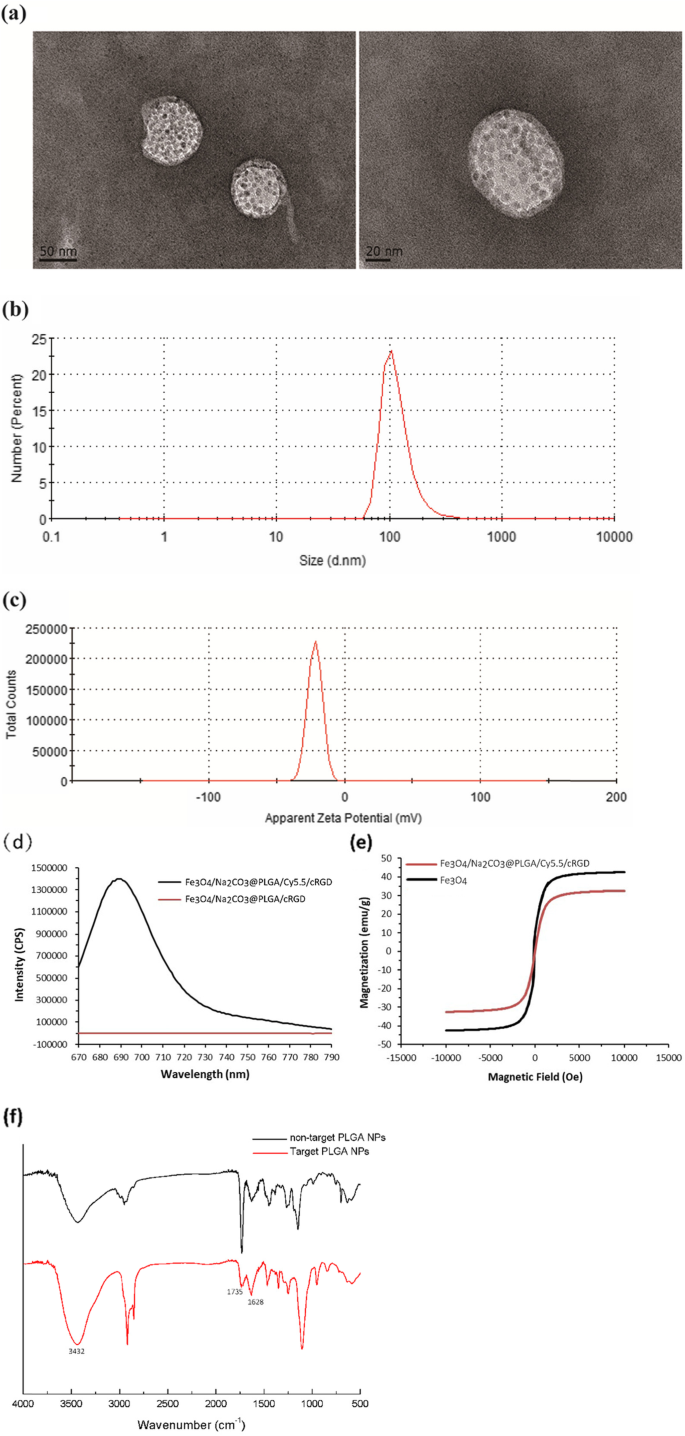
TEM画像( a )サイズ分布( b )ゼータ電位( c )のFe 3 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNP。 d Fe 3 の蛍光発光スペクトル O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDおよびFe 3 O 4 / Na 2 CO 3 @ PLGA / cRGDNP。 e Fe 3 の磁気ヒステリシス曲線 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNPおよびFe 3 O 4 NP。 f ターゲットFe 3 のスペクトルのFTIR O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDおよび非ターゲットPLGANP
Na2CO3 / Fe3O4@PLGA/Cy5.5/RGDNPのinvitro結合
αvβ3インテグリンは一般に乳がん腫瘍内皮細胞で高度に発現しており、腫瘍転移を促進する可能性があります[33、34、35、36]。 MDA-MB-231細胞におけるαvインテグリンの発現の細胞免疫蛍光は、MCF-7細胞よりもはるかに高かった。 A549細胞はポジティブコントロールとして機能しました(図2a)。 NPの細胞取り込みはCLSMによって研究されました(図2b)。 Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、非標的NPよりもMD-MB-231細胞に対してはるかに高い結合率を示しました。蛍光画像はまた、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは細胞質に結合し、マージされた画像はαvインテグリンの発現と同じ位置を示しました[37、38]。
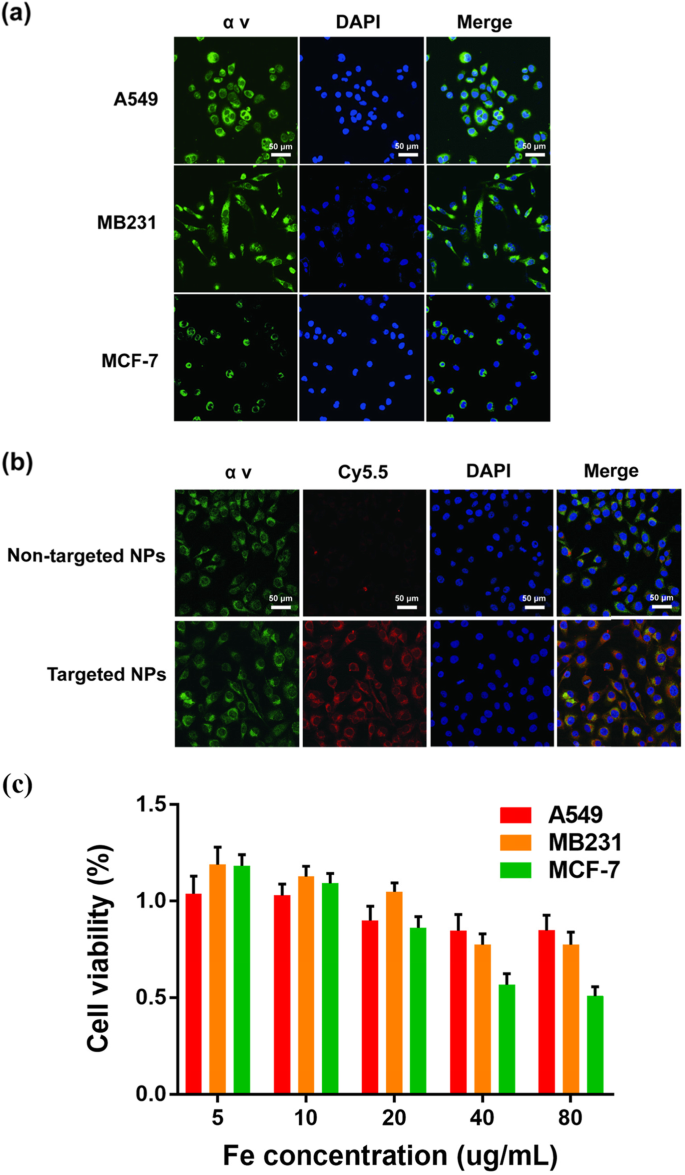
a MB231、A549、およびMcf-7細胞でのαvインテグリンの発現を伴う共焦点蛍光画像。青と緑はそれぞれDAPIとαv蛍光を表します。 b 標的Fe 3 とインキュベートしたMB231細胞の共焦点蛍光画像 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNPおよび非ターゲットNP。青、赤、および緑は、それぞれDAPI、Cy5.5、およびαv蛍光を表します。 c さまざまな濃度のFe 3 とインキュベートしたMB231細胞の相対的な生存率 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGD NP
細胞毒性アッセイ
Na 2 のinvitro細胞毒性 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、CCK8アッセイを使用してMDA-MB-231細胞で推定され、NPで処理されたA549およびMCF-7細胞はコントロールとして使用されました(図2c)。 Fe濃度が5〜80μg / mLの範囲では、A549細胞とMB231細胞の細胞生存率は大幅に低下せず、どちらも70%を超えていました。対照的に、MCF-7細胞は、40μg/ mLを超えるFe濃度で、細胞生存率が約50%まで大幅に低下しました。 CCK8の結果は、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、特定の濃度範囲でMDA-MB-231細胞の細胞毒性が大幅に低下しました。
invitroコントラストイメージング
Na 2 の性能を研究するために、寒天ゲルファントムを使用しました CO 3 / Fe 3 O 4 さまざまなpH値でのinvitroでの@PLGA / Cy5.5 / RGD NP(図3a)。 Na 2 の超音波造影画像 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、弱酸性pH(pH 6.8)でpH 7.2と比較して大幅に強化されました。これは、pH7.2では十分なCO 2 が生成されないためと考えられます。 超音波イメージング用の気泡。対照的に、NPが弱酸性環境にある場合、超音波イメージングに十分な気泡が生成される可能性があります。この特性は、生体内で高い組織の不均一性と多様なpHレベル(pH 6.8–7.2)を示す腫瘍に関連しています[32、39、40]。次に、超音波画像の信号強度を分析しました(図3b)。非標的NP(pH =7)、非標的NP(PH =5)、標的NP(PH =7)、および標的NP(PH =5)グループの信号強度比(ブランクグループは、それぞれ112%、145%、167%、および178±4%でした。これは、ターゲットNPグループ(PH =5)が最も強いUSシグナルを持っていたことを明確に示しています。
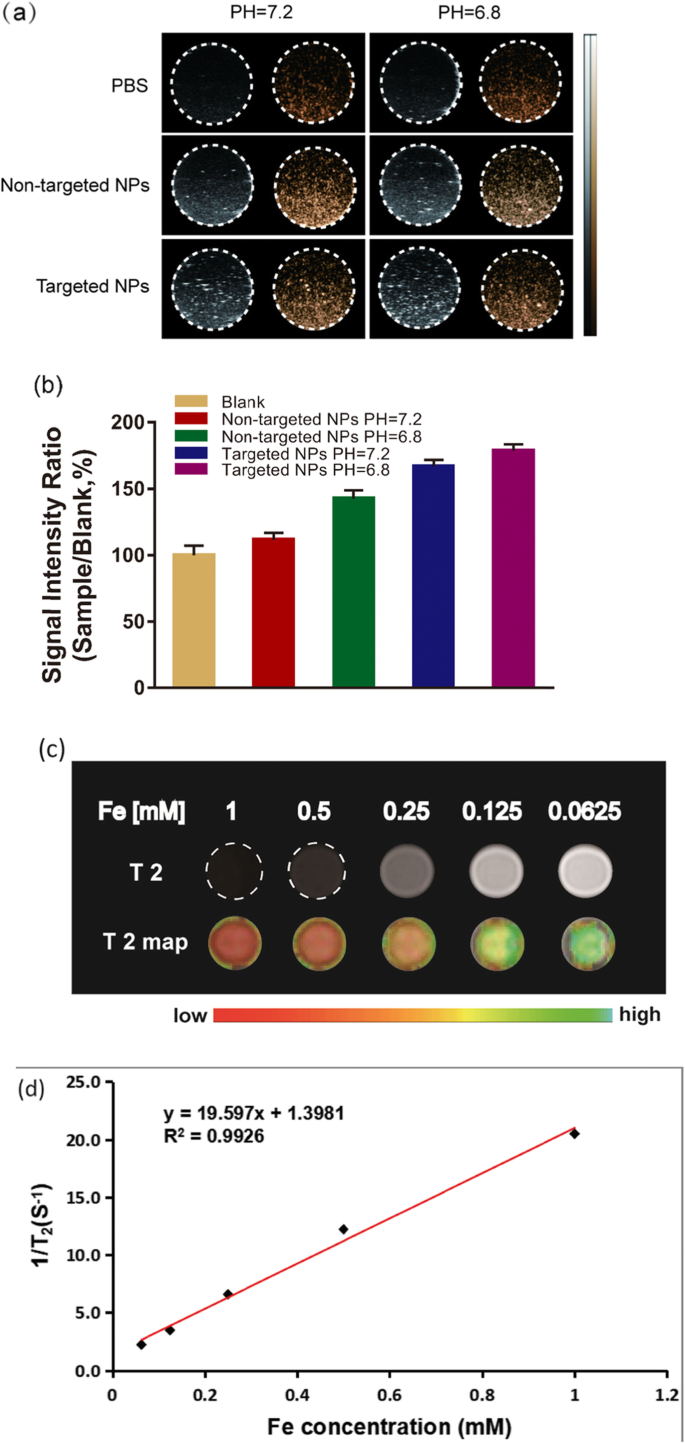
a 異なるpH値(7.2および6.8)で記録されたターゲットNPおよび非ターゲットNPの超音波画像、コントロールとしてのPBS。 b 信号強度率はサンプル/ブランクによって計算され、サンプルはターゲットおよび非ターゲットNPのエコー強度を表し、ブランクはPBSのエコー強度を表します。 c Fe 3 のT2強調MR画像 O 4 / Na 2 CO 3 異なるFe濃度(0.0625、0.125、0.25、0.5、および1 mM)の@ PLGA / Cy5.5 / cRGDNP。 d 横相対性理論(r2)は19.597 mM -1 でした s -1 Fe 3 の場合 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGD NP
インビトロでのMRI研究の場合、Na 2 中のFeの濃度として CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPが増加すると、T2強調信号強度が大幅に減少し、これらのNPがT2 MR造影剤として使用できる可能性が示されました(図3c)。 Na 2 の横緩和率(r2) CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、19.597 mM -1 と計算されました。 s -1 。 Na 2 の横緩和率(r2)は CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、他の多くのMRI超常磁性剤よりも低く、Fe 3 の組成です。 O 4 臨床的に使用されるSPIO粒子のr2より2.94倍高いr2を増やすことができます。
Na 2 の超音波造影イメージング CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NP
Na 2 の可能性を実証するため CO 3 / Fe 3 O 4 腫瘍の超音波画像診断用の@PLGA / Cy5.5 / RGD NPで、Na 2 の尾静脈注射を行いました。 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPを乳がん異種移植ヌードマウスに送り、時間の関数として超音波画像をモニターしました(図4a)。注射前に、腫瘍、肝臓、および皮下領域の画像を記録した。注射直後、腫瘍組織の領域はコントラストの増強を示さなかった。腫瘍領域の増強は、注射後30分から始まり、90分続いたことが観察された。インビボ超音波の結果は、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、酸性腫瘍組織に十分な気泡を生成して、超音波イメージング用のエコー源性反射率を生成しました。コントロールとして、ターゲットNPの注射後のさまざまな時点での肝臓および皮下組織の画像も取得しました。観察期間を通して、皮下注射領域で有意な増強は見られず、時間とともに減少した肝臓での増強は、腫瘍でのそれよりも有意に低かった(図4b)。この結果は、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、生理的pHで体内を循環しているため、大量のCO 2 を生成しません。 超音波造影剤増強のための気泡。
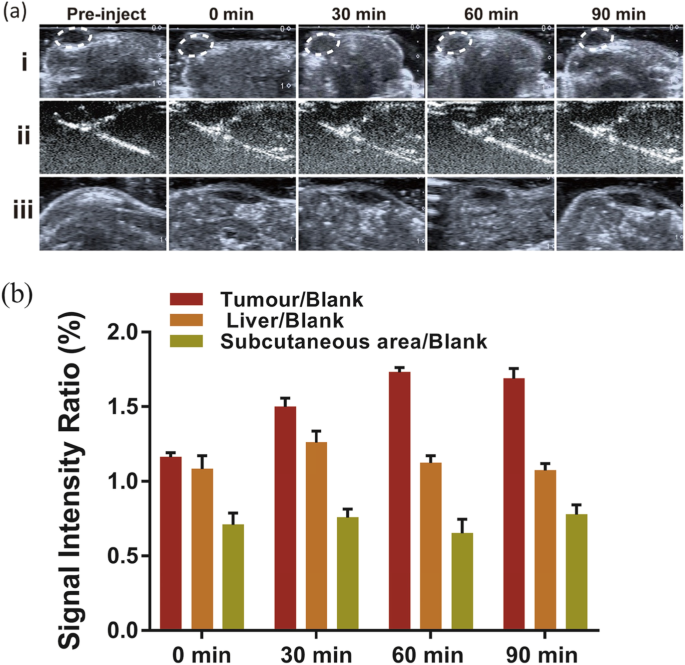
a Fe 3 の注射後のさまざまな時点での腫瘍、肝臓、皮下領域のinvivo超音波画像 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNP。 b 時間の関数としてのエコー強度率は組織/ブランクによって計算され、組織は腫瘍、肝臓、または皮下領域のエコー強度を表し、ブランクは注射前のエコー強度を表します
Na 2のMRI CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NP
in vivo MRIの場合、NPを腫瘍特異的イメージングに使用できることを示すために、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、腫瘍と筋肉に直接注射されました。結果は、腫瘍領域が標的NPの注射後にT2-MR造影剤の有意な減少を示し、信号強度が注射後0分での8875から120分での5972に有意に減少したことを示しました(図5a、b)。ただし、同じ量のナノ粒子を注入すると、皮下筋領域ははるかに低いT2信号の減少を示しました。この発見は、Na 2 の有効性を示しています CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPと、腫瘍を標的としたイメージングで使用するための高感度のインテグリンを標的としたT2-MR造影剤。尾静脈注射群では、T2-MRイメージングでも、注射後24時間で腫瘍のコントラストが明らかに低下し、Na 2 の腫瘍蓄積が高いことが示されました。 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NP(図5c、d)。さらに、肝臓と腎臓でT2信号の減少が観察され、NP内の鉄イオンが体から急速に除去される可能性があることを示しています。したがって、MRIは、PLGAで包まれたFe 3 O 4 ナノ粒子は、強化された透過性と保持(EPR)効果、特にRGDを介したターゲティングを介して効率的な受動的腫瘍ターゲティングを示しましたが、分解されてinvivoで迅速に排泄される可能性があります。
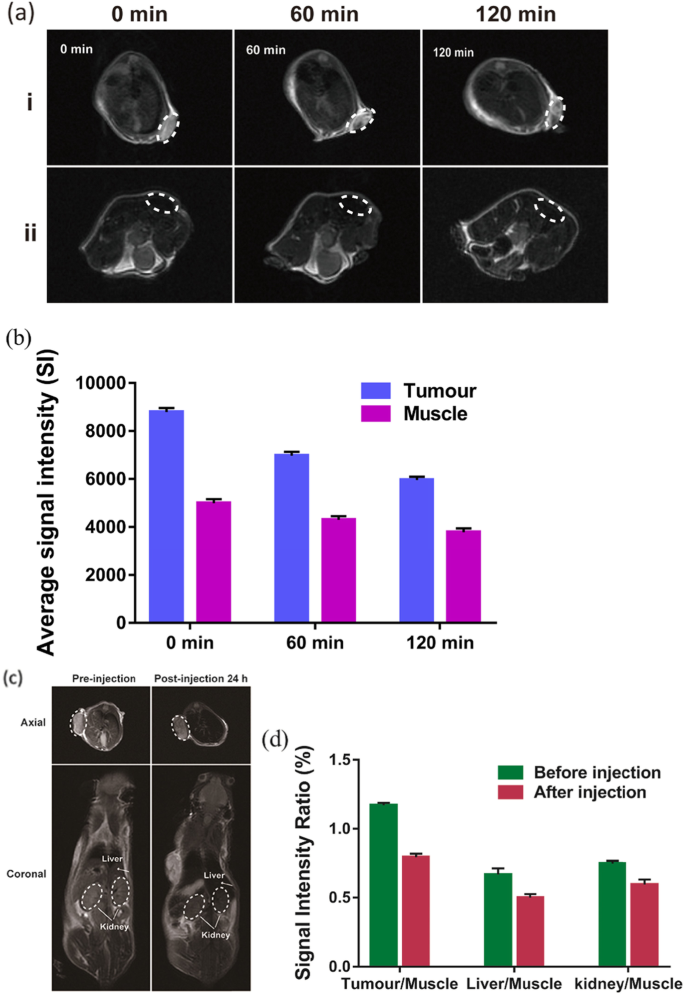
a Fe 3 の注射前後の正常および腫瘍皮下組織のinvivoT2-MR画像 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNP。 b Fe 3 の注射による筋肉と腫瘍の平均信号強度 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNP。 c Fe 3 の静脈内注射前後のMDA-MB-231担癌マウスの軸方向および冠状面のT2-MR画像 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNP。 d 信号強度比は組織/筋肉によって計算されます。組織はターゲットNPの注入前後の腫瘍、肝臓、腎臓の信号強度を表し、筋肉は同時に筋肉の信号強度を表します
蛍光イメージングと組織学
200マイクロリットルのNPを、invivo蛍光イメージングのためにマウスに静脈内注射しました。 RGDを標的としたNPを注射したグループでは、Cy5.5の蛍光シグナルは腫瘍領域で徐々に増加し、注射後4時間でピークに達し、Na 2 であることを示しています。 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、腫瘍に効果的に蓄積する可能性があります。非標的群では、NPは注射後に全身に分布し、急速に除去され、長期間腫瘍に蓄積しませんでした(図6a)。次に、マウスを解剖し、主な臓器と腫瘍をin vitro蛍光イメージングのために収集しました。これにより、標的となるNPの腫瘍への取り込みが高いことが明らかになりました(図6b、c)。標的NPを注射したマウスの腫瘍におけるCy5.5の蛍光強度は、非標的NPを注射したマウスの1.5倍でした。
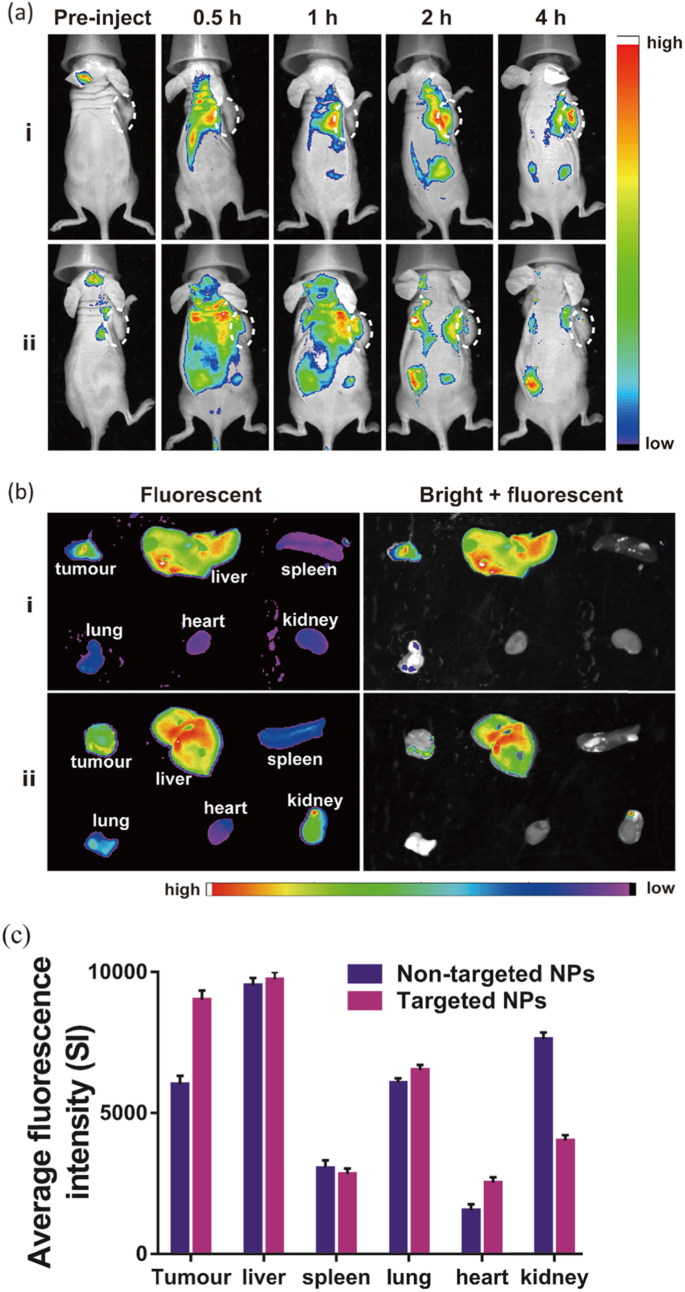
a 標的および非標的NPの注射後の注射後0、0.5、1、2、および3時間での動物のinvivo蛍光蛍光イメージング。 b動物から収集した腫瘍および主要臓器(肝臓、脾臓、肺、心臓、腎臓)のexvivo蛍光画像。 c さまざまな臓器や腫瘍の平均蛍光強度
さらに、Na 2 の腫瘍特異的ターゲティング CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、凍結腫瘍切片の組織蛍光イメージングによって検証されました(図7a)。 αvおよびβ3インテグリンに対する抗体を用いた腫瘍切片の免疫蛍光染色は、腫瘍組織におけるαvβ3インテグリンの有意な発現を明らかにした。 αvおよびβ3インテグリンの蛍光は、Na 2 のCy5.5蛍光と統合されました。 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、共局在を明らかにする免疫染色画像を取得します。腫瘍組織における免疫蛍光の結果は、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、MB231悪性乳がんのαvβ3インテグリンに特異的に結合します。さらに、Na 2 のH&E染色 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、非標的グループと比較して、すべての臓器組織切片が正常な病理学的形態を示し、組織病理学的損傷反応がないことを示しました(図7b)。上記の細胞毒性および組織学的分析のすべての結果は、Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、in vivoで主要な臓器組織に有意な毒性を誘発せず、それらの良好な生体適合性は、PLGAに合理的に起因する可能性があります。
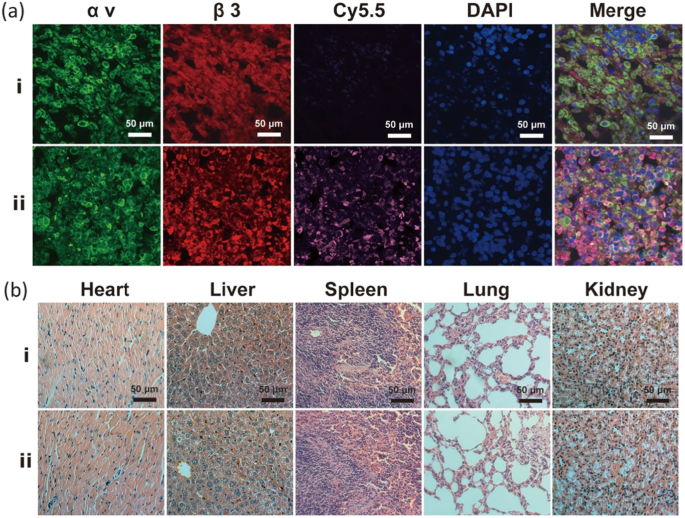
a 標的および非標的NPを注射したマウスのMDA-MB-231腫瘍凍結切片の蛍光イメージング。緑、赤、紫、青はそれぞれαv、β3、Cy5.5、DAPIの蛍光を表します。 b 標的および非標的NPの注射後にマウスから収集されたH&E染色腫瘍スライス
結論
結論として、上記の結果は、磁気ターゲティングと腫瘍微小環境で活性化されるガス発生システムを介した乳がんのMRIに対する創造的で成功したアプローチを示しています。 Na 2 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、MR /超音波/蛍光イメージングモードで優れたイメージング性能と優れた生体適合性を示します。私たちの研究は、改善されたマルチモーダルイメージングによる腫瘍診断の強力な可能性を示しています。
材料と方法
資料
ポリ(乳酸-co-グリコール酸)(PLGA)(ラクチド:グリコリド=75:25、Mw =20,000)、シアニン5.5色素、およびポリビニルアルコール(PVA)は、Sigma-Aldrich Company(上海、中国)から購入しました。 RGDペプチドは、GenicBio BioTech Co. Ltd.(上海、中国)によってカスタム合成されました。 Fe 3 O 4 ナノ粒子と炭酸ナトリウム(Na 2 CO 3 )はXian Ruixi Biological Technology Co. Ltd.(Henan、China)から購入しました。ジクロロメタン(CH 2 Cl 2 )およびジメチルスルホキシド(DMSO)は、Solarbio Company(北京、中国)から入手しました。すべての化学物質は分析グレードでした。
Fe3O4 / Na2CO3 @ PLGA / Cy5.5 / cRGDナノ粒子の合成
まず、12.5mgのPLGAと0.25mLのクロロホルムを混合しました。次に、5μLのCy5.5、15μLのオレイン酸修飾磁性ナノ粒子をクロロホルム(OA @ Fe 3 O 4 、10 mg / mL)、5μLの炭酸ナトリウム(Na 2 CO 3 )、および1.5 mLの1%PVA溶液を順番に添加し、超音波プロセッサーで2分間乳化しました。次に、12.5 mLの0.3%PVA溶液を加え、室温で3〜4時間撹拌し、12.5 mLの0.4%PVA溶液を加えて一晩撹拌(500 rpm / min)して、残留有機溶媒を除去しました。上記の溶液を、ddH 2 で数回限外濾過洗浄した。 O次に、PBバッファー(pH =7.4)で最終容量1.25mLに希釈します。次に、0.25mgのEDCと1.25mgのNHSを上記の混合溶液に加えた。混合物を25℃で30分間撹拌し、次に限外濾過で3回洗浄し、PB緩衝液(pH =7.4)に再懸濁した。次に、1.25 mgのcRGDを溶液に加え、4℃で一晩撹拌しました。 EDC、NHS、および残留cRGDを除去するために、透明な溶液を限外ろ過チューブでろ過しました。最後に、Fe 3 O 4 / Na 2 CO 3 @ PLGA / Cy5.5 / cRGDNPを1.25mLの脱イオン水に再懸濁し、4°Cで保存しました。
ナノ粒子の特性評価
ナノ粒子の動的直径とゼータ電位は、Zetasizer Nano-ZS(Malvern Instruments、UK)によって測定されました。ナノ粒子の形態は、FEI TecnaiF20透過型電子顕微鏡を使用して取得しました。 Cy5.5の負荷は、HitachiF-7000蛍光分光計によって記録されました。 FTIRは、フーリエ変換赤外分光計(Alpha II、Bruker、スイス)を使用して実行されました。振動試料型磁力計(VSM、レイクショア7410)を適用して、ナノ粒子と遊離Fe 3 のヒステリシス曲線を決定しました。 O 4 。
細胞と動物
ヒト乳がんMDA-MB-231細胞は、中国科学院の幹細胞バンクから提供されました。セルは、95%の空気と5%のCO 2 で37°Cに維持されました。 。雌のBALB / cマウス(4週間)はShanghai Slaccas Laboratory Animal Co. Ltd.から購入し、広西医科大学実験動物センターによって承認されたプロトコルに従って維持されました。動物実験の後には、広西医科大学の実験動物センターの動物倫理委員会が発表した実験動物の管理と使用に関するガイドがありました。 MDA-MB-231乳がん細胞をBALB / cマウスの右側腹部に移植し(マウスあたり200μlの細胞で2×106)、イメージングの前に10〜14日間(平均直径5mm)増殖させました。
MDA-MB-231細胞におけるαvインテグリンの高発現を確認するために、細胞免疫蛍光法を実施しました。 A549およびMCF-7細胞をコントロールとして使用しました。細胞を35mmガラス底培養皿(MatTek、USA)に2×10 4 で播種しました。 細胞mL -1 24時間。インキュベーション後、細胞を4%パラホルムアルデヒドで室温で20分間固定しました。次に、ウサギモノクローナル抗インテグリンαv抗体(ab179475、Abcam)と4°Cで一晩、抗ウサギIgG抗体と室温で1時間インキュベートしました。最後に、細胞をDAPIで染色しました。画像は、共焦点レーザー走査顕微鏡(TCS SP8、ライカ、ドイツ)によって取得されました。
ナノ粒子のターゲティング効果を評価するために、共焦点レーザー走査顕微鏡(CLSM)を使用して細胞取り込み研究を実施しました。細胞を35mmガラス底培養皿(MatTek、USA)に2×10 4 で播種しました。 細胞mL -1 24時間。次に、細胞をRGDを標的としたNP(30μgmL -1 )とともにインキュベートしました。 、0.5 mL)、pH 7.4で2時間、非標的NPをコントロールとして使用しました。インキュベーション後、細胞を4%パラホルムアルデヒドで20分間固定し、αv抗体とインキュベートしました。共局在化により、細胞上のインテグリンへのナノ粒子の標的結合を検証しました。
CCK8アッセイ
Na 2 の生体適合性 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGDナノ粒子は、細胞毒性研究によって評価されました。 MDA-MB-231、A549、およびMCF-7細胞を、5×10 3 で96ウェルプレートに播種しました。 細胞mL -1 24時間。次に、0.1mLのNa 2 CO 3 / Fe 3 O 4 5、10、20、40、および80μg/ mLのFe濃度の@PLGA / Cy5.5 / RGD NP懸濁液を各ウェルに添加し、24時間インキュベートしました。最後に、10μLのCCK8溶液を加え、懸濁液をさらに1時間インキュベートしました。結果は、マイクロプレートリーダー(Thermo Scientific、USA)によって450nmで測定されました。
造影超音波イメージング
ナノ粒子の超音波イメージングは、Vevo 2100(Fujifilm Visual Sonics Inc.、Canada)超音波システムを使用して実行されました。 RGDを標的としたNPと標的を定めていないNPをアガロースモデルに追加し、PBSをコントロールとして使用しました。画像は、7.2と6.8の異なるpHバッファーを使用してBモードとCEUSモードで記録されました。関心領域が描画され、平均グレー値がBモード画像で測定されました。
インビボ超音波イメージングでは、マウスを2%イソフルラン(Hebei Yipin Pharmaceutical Co.、Ltd.、China)で麻酔し、加熱パッドで体温を37°Cに維持しました。合計200μLのRGDを標的としたNPを尾静脈から注入しました。対照動物は、同量のNPを皮下注射した。超音波画像は、腫瘍、肝臓、および皮下領域の超音波画像を継続的に取得するために、7MHzトランスデューサーを使用して記録されました。音響フォーカスゾーンは、最大の断面を持つ腫瘍の中心に配置され、腫瘍とその隣接組織を含む視野が得られました。
磁気共鳴画像法
Na 2 のMRI検査 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGD NPは、3.0 T MR(GE Healthcare、米国)と動物コイル(RF TECH LIMITED、中国)を使用して実行されました。異なるFe濃度が0.031、0.063、0.125、0.25、0.5、および1mMのNPを1mLのEppendorfチューブでスキャンし、PBSをコントロールとして使用しました。 T2 MRIは、T2強調FSEシーケンス(スライス厚3 mm、TR / TE 2000 / 74.4 ms、8×8 cm FOV、320×256マトリックス)を使用して各チューブに対して実行されました。緩和度(r2)は、Fe濃度の関数としての逆緩和時間の線形フィッティングによって計算されました。
インビボMRIの場合、マウスはランダムに2つのグループに分けられました( n =3)いずれかの(1)Na 2 の局所注入を受けたMRスキャンの場合 CO 3 / Fe 3 O 4 皮下筋肉および腫瘍組織内の@PLGA / Cy5.5 / RGD NP、または(2)Na 2 の尾静脈注射 CO 3 / Fe 3 O 4 @ PLGA / Cy5.5 / RGDNP。マウスのベースライン画像は、ナノ粒子の注射前に撮影されました。グループ1では、同量のNPを皮下組織と腫瘍組織に注入し、30分ごとにMRIスキャンを実行して、組織の信号遷移を記録しました。グループ2の場合、腫瘍イメージングは軸方向および冠状位置で実行され、MRパラメーターはinvitroイメージングに使用されたものと同じでした。関心領域(ROI)の信号強度(SI)を測定し、注射前後のさまざまな時点で組織信号と比較しました。
腫瘍蛍光イメージング
インビボでの蛍光イメージングでは、インビボ蛍光イメージングシステム(FX PRO、ブルカー、スイス)をスキャンに使用し、マウスをランダムに2つのグループ( n )に分けました。 =3):( 1)RGDを対象としたNPおよび(2)非対象のNP。画像は、注射後4時間、30分ごとにキャプチャされました。続いて、重要な臓器や腫瘍を採取して画像化し、体の臓器における蛍光の分布を観察しました。蛍光強度の定量分析は、分子イメージングソフトウェア(Bruker、スイス)を使用して実行されました。次に、これらの重要な臓器は、組織毒性を評価するためにH&E染色を受けました。凍結腫瘍切片は、αvインテグリンおよびβ3インテグリンに対する抗体を用いた蛍光免疫染色にも供されました。
データと資料の可用性
この原稿でなされた結論は、この論文で提示され示されているすべてのデータに基づいています。
略語
- Cy5.5:
-
スルホシアニン5.5NHSエステル
- DAPI:
-
4 '、6-ジアミジノ-2-フェニルインドール
- EDC:
-
1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩
- FSE:
-
高速スピンエコー
- MR:
-
磁気共鳴
- NHS:
-
N-ヒドロキシスクシンイミド
- PB:
-
リン酸緩衝液
- PBS:
-
リン酸緩衝生理食塩水
- PEG:
-
ポリエチレングリコール
- PVA:
-
ポリビニルアルコール
- RGD:
-
アルギニン-グリシン-アスパラギン酸
- TE:
-
エコー時間
- TR:
-
繰り返し時間
ナノマテリアル
- 化学療法センサー用の金ナノ粒子
- 卵巣癌細胞の高感度かつ迅速な検出のための柔軟なグラフェンベースのバイオセンサーのデモンストレーション
- 癌治療のためのナノ粒子:現在の進歩と課題
- 黒色腫の標的化学療法治療のための薬物送達担体としての131I追跡PLGA-脂質ナノ粒子
- 子宮頸がんにおける抗がん効果を高めるための葉酸受容体を標的としたバイオフラボノイドゲニステインをロードしたキトサンナノ粒子
- In VivoCTイメージングおよび腎クリアランス特性のための新しい生体適合性AuNanostars @PEGナノ粒子
- 光熱治療および光音響イメージングのためのポリピロール被覆鉄-白金ナノ粒子の合成およびinvitro性能
- 細胞イメージング用の近赤外発光Cr3 + / Eu3 +共ドープ亜鉛ガロゲルマネート持続性発光ナノ粒子
- Auナノ粒子で調整されたシリカ珪藻殻により、生物学、安全、環境アプリケーション向けの分子の高感度分析が可能になります
- HER2発現癌のinvivoMRイメージング用のアプタマー修飾磁気ナノ増感剤
- 未分化甲状腺癌における131I標識抗VEGFR2標的メソポーラスシリカナノ粒子の抗腫瘍効果



