高炉プロセスによる製鉄の化学
高炉プロセスによる製鉄の化学
低コークス率で運転する最新の高炉(BF)は、主に向流気固反応器の固有の特性のために効率的な処理装置です。この概念をうまく利用するには、炉に投入される各材料が均一な物理的特性を持ち、均一な組成を持っている必要があります。さらに、各材料は、炉を通って溶融が発生する場所まで移動するときに、この優れた物理的特性を保持する必要があります。
酸化鉄、コークス、およびスラグ形成材料が炉のスタックを通って下に移動すると、いくつかの重要な交換プロセスが発生します。一酸化炭素(CO)、二酸化炭素(CO2)、窒素(N2)を主成分とする上昇炉ガスから熱が除去され、下降負荷物質に伝達されます。酸素(O2)は、下降する酸化鉄から除去され、上昇する還元性ガスに移動します。したがって、この非常に効率的な向流反応器内で化学反応が起こり、装入物が下降すると、装入物の温度が上昇し、還元鉄、酸化鉄、およびスラグ形成材料の融合が始まり、最後に液体金属とスラグが集まります。炉の炉床。炉に装入されたコークスの大部分は、羽口の熱風で酸素と一緒に燃焼され、熱と還元剤COの両方を提供します。
BFの上部に装入された装入物とコークスが煙突を通って下降するとき、それらは羽口から上昇する高温ガスによって予熱されます。この予熱の結果、コークスは羽口に隣接する炉の下部に到達し、熱風と接触すると、非常に激しく燃焼します。しかし、非常に高温(約1,650℃)とコークスとして存在する大量の炭素(C)のために、形成されたCO2は安定せず、すぐに追加の炭素と反応してCOを形成します。 BFの炭素(コークス)は、化学方程式2C + O2=2COで表すことができます。デルタH=+110,458 kJ/kmol。最新のBFの運用では、250 kg(kg)から400 kgの炭素が、生成される溶銑1トンごとにこのように反応します。この反応は製錬作業の主な熱源であり、還元ガス(CO)を生成します。このガスは炉床に上昇し、そこで予熱され、炉床に降下する際に負荷の酸化鉄の大部分を還元します。
>
ブラストエア内の水分(H2O)も、燃焼ゾーンのコークス内の炭素の一部と反応します。この反応は、燃焼のように熱を発生させるのではなく、むしろ熱を消費します。ただし、炭素の単位ごとに、この反応は、炭素を空気中で燃焼させたときに生成されるガスよりも多くの還元ガスを生成します。炭素が空気中で燃焼すると、1単位のCOしか生成されませんが、H2Oと反応すると、1単位のCOと1単位の水素(H2)が生成されます。したがって、負荷材料の固有の減少率が通常よりも低く、比較的高い熱風温度(1,000℃から1,200℃の間)が利用可能である特定の例では、 BFガスの還元力を高めるための水分(蒸気)添加による均一に高いレベルの爆風の含水量。補助燃料噴射も同様の利点を提供します。この化学反応は、式C + H2O =CO+H2で表されます。デルタH=+131,378 kJ/kmol。追加の利点は、炉還元ガスへの水素の導入(または増加)から得られます。水素の割合が増えると、ガスの密度は低下します。これにより、同等の量の還元ガスが発生し、適切な負担に対する抵抗が少なくなります。
上昇するガスは、温度が925℃未満であるBFの上部で負荷の酸化鉄を還元し始めます。この温度では、化学平衡により、すべてのCOとH2が還元に使用されなくなります(平衡CO / CO2比は、この値を下回ると鉄が再酸化されるため、wustiteの還元では約2.3です。したがって、酸化鉄に対するCOまたはH2の分子比は、化学量論的反応で示される量の約3倍になります(i )1/2 Fe2O3 + 3/2 CO =Fe +3/2CO2;デルタH=+12,866 kJ / kmol、(ii)1/3 Fe3O4 + 4/3 CO =Fe +4/3CO2;デルタH=+3940 kJ / kmol、(iii)FeO + CO =Fe+CO2;デルタH=–16,108 kJ / kmol、(iv)1/2 Fe2O3 + 3/2 H2 =Fe +3/2H2O;デルタH=+ 48,953 kJ / kmol、(v)1/3 Fe3O4 + 4/3 H2 =Fe +4/3H2O;デルタH=+51,042 kJ / kmol、および(vi)FeO + H2 =Fe+H2O;デルタH=+ 25,104 kJ/kmol。
過去には、このタイプの還元は、直接還元と呼ばれる高温で発生するタイプとは対照的に、間接還元と呼ばれていました。ただし、Wiberg、HIB、FIORなどのDRIプロセスを説明する際に、これらの同じ化学反応が直接還元と呼ばれるため、この命名法は混乱を招きます。このため、これらの用語は、以前のように通常は使用されません。
温度が比較的低い炉の上部で還元されない酸化鉄の部分は、温度が非常に高い下部で還元されます。 CO2とH2Oは、大量のコークスが存在する場合、これらの温度では安定しないため、生成するのとほぼ同じ速さで炭素と反応します。結果として、炉のこの部分での全体的な還元反応は、反応FeO + C =Fe+COで表すことができます。 H2またはCOが反応物であるかどうかに関係なく、デルタH =+156,482 kJ/kmol。この反応は、FeO + CO =Fe+CO2のいずれかの反応を代数的に加算することによって得られます。デルタH=–16,108 kJ / kmol、およびCO2 + C =2CO;デルタH=+172,590 kJ/kmolまたは反応FeO+H2 =Fe + H2O;デルタH=+25,104 kJ / kmol、およびH2O + C =CO + H2;デルタH=+131,378 kJ/kmol。
還元反応FeO+C =Fe + COは大量の熱を吸収するため、このように還元される量が多いほど、炉に供給される熱量が多くなります。この反応はまた、BFスタックで行われる還元反応で使用されるガスであるCOを生成します。ほとんどの場合、最も効率的な操作は、還元の約3分の1が反応FeO + C =Fe + COに従って行われ、残りが反応Fe2O3 + 3 CO =2 Fe +3CO2による場合に達成されます。 FeO + H2 =Fe+H2O。
BFの大部分では約40%が熱風の顕熱から供給されるため、プロセスの熱はコークスの燃焼によって完全に生成されるわけではありません。燃料のかなりの部分は、天然ガス、タール、燃料油、または微粉または粒状の石炭として、羽口から経済的に注入することができます。このような場合、燃料中の炭素はCOに燃焼しますが、大量のコークスが存在するため、水素はH2として残り、羽口の上のどこかで酸化鉄を還元するまで酸化されません。
炉への装入物に含まれる鉄含有成分は、鉄の単純酸化物、Fe2O3、およびFe3O4です。天然鉱石は通常、ヘマタイト(Fe2O3)またはマグネタイト(Fe3O4)です。ペレットは主にFe2O3です。鉄鉱石焼結体の組成は、Fe2O3およびFe3O4から、マグネタイト、ファヤライト、2FeO.SiO2、および二カルシウムフェライトを含む溶融混合物までさまざまです。酸化鉄の還元は通常段階的に行われます。 COとの反応は、式(i)3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g)で与えられます。デルタH-48kJ、(ii)Fe3O4(s)+ CO(g)=3FeO(s)+ CO2(g);デルタH-21.7kJ、および(iii)FeO(s)+ CO(g)=Fe(s)+ CO2(g);デルタH-11kJ。これらの反応は、連続的に高温で、炉のさらに下で達成されます。
上昇するガスによってこれらの反応を完了するには、連続してより高い割合のCOが必要になります。ガス中のCO全体が各反応でCO2に変換されることは不可能であることが認識されるべきである。たとえば、3つの方程式の定数K3と、温度に依存するK3 =P CO2 /PCOによって与えられる平衡比があります。 800℃では、平衡ガス混合物には約65%のCOと35%のCO2が含まれています。この温度でFeOおよび固体鉄と接触するガスのCO2含有量がこの値を超えると、存在する鉄は酸化されてFeOに戻る傾向があります。したがって、これらの反応を強制的に発生させるには、図1に示すように、各ステップでガス中にかなりの濃度のCOが必要であり、反応によってCOを完全にCO2に変換することはできません。図1に、Fe-C-OおよびFe-H-Oシステムの安定性図を示します。 Fe-C-OシステムのS曲線は、「溶液損失」またはBoudouardまたは反応を表します。
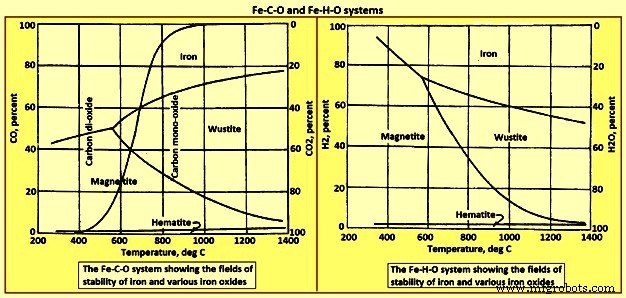
図1Fe-C-OおよびFe-H-Oシステム
補助燃料に含まれる水素と、燃料およびエアブラストからの水分のために、羽口から出るガスにも最大2%または3%の水素が含まれる可能性があります。炉の制御を補助するために、熱風に蒸気を加えることができます。コークスおよび燃料中の炭素による蒸気の還元は、全体的な反応H2O(g)+ C(s)=CO(g)+ H2(g)によって進行します。デルタH=131.3kJ。この反応は吸熱反応ですが、ブラスト内の酸素による炭素の酸化により、式C(s)+ 1/2 O(g)=CO(g)によってCOが形成されます。デルタH=-110.5kJは発熱性です。水素による酸化鉄の還元も、ステップ(i)3Fe2O3(s)+ H2(g)=2Fe3O4(s)+ H2O(g)で進行します。デルタH=-7.1 kJ、(ii)Fe3O4(s)+ H2(g)=3FeO(s)+ H2O(g);デルタH62.9kJ、および(iii)FeO(s)+ H2(g)=Fe(s)+ H2O(g);デルタH=30.2kJ。温度はこれらの反応の平衡に影響します。
水性ガスシフト反応CO2(g)+ H2(g)=H2O(g)+ CO(g);デルタH=41.2 kJは、気相中のさまざまな種の間で発生して、酸素を再分配し、水素含有ガス種と炭素含有ガス種を平衡状態にすることができます。この反応はほとんど熱を必要とせず、平衡定数(P H2O.P CO)/(P H2.P CO2)は825℃で1です。スタック内のガスは、コークスの炭素および酸化物と反応します。担当の鉄の。 COおよびCO2とグラファイトとしての炭素との全体的な反応は、「溶液損失」またはBoudouard反応CO2(g)+ C(s)=2CO(g)です。デルタH172.4kJ。 750℃を超える温度では、反応の平衡は右に大きくシフトします。600℃を下回ると、平衡は左に強くシフトし、その結果、炉の負荷に煤として炭素が堆積します2CO(g)=C(s )+ CO2(g);デルタH=-172.4。図1の左下から中央上部につながる「S」字型の曲線は平衡を表しています。温度と組成が線より上にあるガスは、2番目の反応で炭素を堆積する傾向があり、組成と温度が線より下にあるガスは、最初の反応に従って炭素を酸化します。
高温での炭素溶液反応の主な効果は、必要な羽口で発生する熱の相対的な減少と、700℃を超える炉の領域でのガス中のCO濃度の増加です。この後者の条件は次のとおりです。ガスの量を増やし、熱伝達を助けるので、特に望ましい。溶液損失反応と反応FeO(s)+ CO(g)=Fe(s)+ CO2(g)の組み合わせに注意してください。デルタH-11kJは、式FeO(s)+ C(s)=Fe(s)+ CO(g)で与えられる炭素によるFeOの「直接」還元に対応します。デルタH=131.3kJ。図1から明らかなように、煙突を通過するガスは、通常、コークス中の炭素および下降負荷中の酸化鉄と平衡状態にあることはできません。 BFスタック内のガス組成と温度の実際の関係は、実際に採用されている方法に大きく依存します。
酸化物の相対的安定性
さまざまな酸化物の相対的な安定性が、エリンガム図に温度に対してプロットされています(図2)。エリンガム図は、BF内の酸化物の挙動を理解するのに非常に役立ちます。相対的な安定性は、酸化物の形成の自由エネルギーの観点から測定されます。酸化物の形成の負の自由エネルギーが高いほど、酸化物の安定性は高くなります。これは、図の上部にある酸化物の安定性が比較的低く、図の下部にある酸化物の安定性が高いことを意味します。図の中央にある酸化物は、適度な安定性を持っています。安定性が比較的低い酸化物には、酸化カリウム、酸化ナトリウム、酸化リン、酸化鉄などがあります。中程度の安定性を持つ酸化物には、酸化マンガン、酸化クロム、シリカ、酸化チタンなどがあります。 。安定性の高い酸化物には、アルミナ、マグネシア、石灰などがあります。
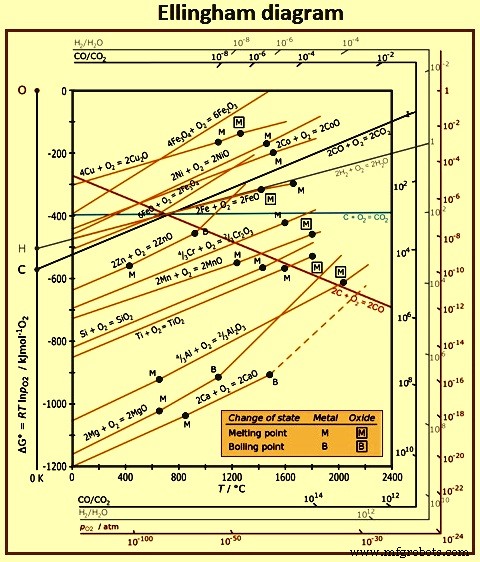
図2エリンガム図
元素の酸素に対する親和性の観点からこの図を検討することも有用です。たとえば、図の上部にある要素は酸素に対する親和性が低く、図の下部にある要素は酸素に対する親和性が高くなっています。これは、上部の酸化物は比較的還元しやすいのに対し、下部の酸化物は還元が難しいことを意味します。これは、BF炉床で見られる温度に対応する温度で酸化鉄を形成するための線の上にある酸化リンの形成のための線によって示されています。これは、酸化リンの安定性が酸化鉄よりも低いことを意味します。したがって、炉内の還元条件は酸化鉄を還元するのに十分であるため、本質的に炉に入るすべてのリンは溶銑に行き着きます。一方、アルミナ、マグネシア、石灰などの安定した酸化物は、BF条件下では還元されず、最終的にスラグ相になります。酸化マンガン、酸化クロム、シリカ、酸化チタンなどの適度な安定性を持つ酸化物は、部分的に還元されて溶銑に溶解したマンガン、クロム、シリコン、チタンを生成しますが、残りの還元されていない酸化物はスラグの一部を構成します。
エリンガム図は、単位活性の純粋な元素が1モルの酸素ガスと反応して、単位活性の純粋な酸化物を形成することに基づいて作成されています。熱力学的用語「活性」は、溶鉄に溶解した元素、または液体スラグに溶解した酸化物の挙動を説明するために特に有用な概念です。たとえば、酸素や硫黄などの低濃度の元素が溶鋼に溶解している場合、それらの活性は、パーセント単位の濃度に等しいと見なされることがよくあります。ただし、他の元素、たとえば溶銑中の炭素が高濃度で存在する場合、硫黄の活性は濃度よりも高く、酸素の活性は濃度よりも低くなります。このような場合、活動と集中力を区別することが重要です。・溶液中の成分の濃度は、成分がどれだけ存在するかの尺度です。・ソリューション内のコンポーネントのアクティビティは、コンポーネントが実際にどのように動作するかの尺度です。
エリンガム図のすべての線は、炭素を含む線を除いて正の傾きを持っており、温度の上昇とともに酸化物の安定性が低下することを示しています。酸化カリウム、酸化ナトリウム、マグネシア、および石灰の酸化物の線は、それぞれ、それぞれの金属の沸点に対応する温度で勾配の増加を示しています。炭素と酸素からのCO2の生成線は、温度の上昇に伴う安定性の変化がほとんどないことを示すほぼゼロの傾きを持ちますが、COの線は強い負の傾きを持ち、温度が上昇するにつれてCOの安定性が実際に増加することを意味します。炭素の2つの酸化物の線は、約700℃で交差します。この温度を超えると、COはCO2よりも安定しますが、低温では、CO2はCOよりも安定します。
炭素-酸素反応
約1,000℃から1,200℃の温度と0.2MPaから0.3MPaの圧力で羽口を通して注入された予熱されたエアブラストは、各羽口の前に洋ナシ形の反応ゾーンを生成します。この領域の温度は約2,000℃で、最初に過剰な酸素とコークスの間で急速な反応が起こり、CO2が生成されます。これは発熱反応です(C + O2 =CO2)。このゾーンのすぐ外側では、利用可能な遊離酸素がなくなり、CO2が過剰なコークスと反応してCOを生成します(CO2 + C =2CO)。これはBoudouard反応として知られており、吸熱反応です。これらの2つの反応を組み合わせると、炭素と酸素の部分燃焼の反応が得られ、COが生成されます(2C + O2 =2CO)。 1モルのCO2の形成で発生する熱は、1モルのCOの形成の約3.5倍であり、BFの効率の1つの尺度は、コークス中の炭素のCO2への変換の程度です。
700℃未満では、CO2はCOよりも安定しており、2番目の反応は左に進みます(2CO =C + CO2)。この反応は、しばしば炭素堆積と呼ばれます。 700℃を超えると、COはCO2よりも安定し、2番目の反応は右に進みます。この反応は、炭素溶液損失反応と呼ばれることもあり、この意味で否定的な振る舞いを意味します。一方、この反応は、700℃を超える炉の領域内での還元ガスの再生を表します。これは、BF内のコークスの重要な機能の1つであり、ガスの量を増やして熱を助けるため、特に望ましいものです。移行。ただし、この反応は吸熱反応であり、羽口ゾーン内で発生すると、高温が重要な場所で冷却効果が発生します。
コークスと、0.1MPaおよび0.3MPaの圧力で、COとCO2を含むガス混合物との間の平衡反応に対する温度の影響を図3に示します。はCO2よりも安定していますが、グラフの左側の低温では、CO2はCOよりも安定しています。この図から、1,000℃を超えると、コークスと平衡状態にあるCO2の割合が本質的にゼロになることがわかります。一方、400℃以下の温度では、COの濃度は低くなります。したがって、温度が1,000℃から400℃の間で低下すると、COの安定性が低下し、CO2の安定性が向上し、コークスと平衡状態にある両方のガスの分圧が大きくなります。
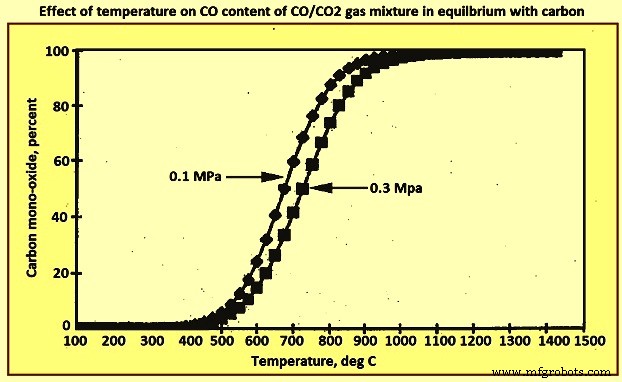
図3炭素と平衡状態にあるCO/CO2ガス混合物のCO含有量に対する温度の影響
炉の上部を出るガスは通常約200℃であり、コークスで平衡が達成される場合、CO対CO2の比率は約10対電力-5になります。実際、この比率は通常1〜3です。つまり、ガスは平衡の考慮から予測されるものよりもはるかに還元的であり、ガスの還元ポテンシャルを十分に活用していません。これは、コークス率が理論上の要件を超えていることを意味します。ガスとコークスの間のこの平衡の欠如は、主にスタック内の高いガス速度に起因する可能性があります。炉内のガス保持時間はわずか約10秒であり、特に緩く充填されたコークスが豊富な領域では、非常に高い速度が発生する可能性があります。もう1つの要因は、ガスの温度が炉内を上昇するときに約1,800℃低下するため、平衡を維持する機会がほとんどないことです。
炭素堆積反応
1,000℃未満の温度でのBFのスタック内のガスのCO含有量は、必要とされるよりもかなり高いため、炭素堆積または煤煙反応を進行させるための推進力が存在します。この駆動力は、500℃から700℃の間で特に強くなります。図3の線より上の温度と組成のガスは、2CO =C + CO2の反応によって炭素を堆積する傾向があり、組成と温度がlineは、CO2 + C=2COの反応に従って炭素を酸化します。幸いなことに、炭素堆積反応は遅く、平衡が達成されることはありません。そうしないと、スタックの最上部にある負荷内のスペースの深刻な目詰まりが発生する可能性があります。
これにより、還元ガスの不規則な流れと負荷の不均一な降下につながる可能性があります。部分反応の場合でも、炭素が核形成して成長できる適切な触媒表面が必要です。鉄粒子、部分還元鉄鉱石、および炭化鉄はすべて、可能な触媒として提案されてきた。反応は水素と水蒸気によって促進されるように見えますが、窒素と硫黄の化合物、たとえば、アンモニア、硫化水素、二硫化炭素は抑制剤として機能します。酸化亜鉛とアルカリ性化合物は硫黄の抑制効果に対抗し、炉内のこれらの化合物の濃度は通常は低いですが、炉内で高温で揮発し、スタックのより低温の領域で再び凝縮します。累積的な効果は、そのような化合物が硫黄の影響を相殺できることです。反応によって堆積した炭素は非常に細かく分割された形であり、一部は鉄鉱石粒子の細孔内に収容され、再びスタックを下に移動することができます。これは、いくつかの方法で削減プロセスに影響を与える可能性があります。
炭素の活性性と鉱石との密接な関係により、固体炭素による還元は、コークスによる還元に必要な温度よりも低い温度で行うことができます。特に、コークスは細孔に浸透できず、還元はポイントでのみ行うことができるためです。固体粒子間の接触の。そのような還元の速度は、粒子の内部から接触点への酸素の拡散の速度に依存します。炉の上部では、ガス状の還元と比較して、コークスによる還元はごくわずかです。スラグの形成によってガス反応が妨げられる場合、それは約1,000℃を超えるとかなり大きくなります。対照的に、沈殿した炭素による還元は、800℃という低い温度で発生する可能性があります。
細孔内での反応中のCOの形成は、粒子内の深い亀裂を開く傾向があり、したがって、気固接触面積が増加し、ガス還元の効率が増加します。ガス状還元反応により粒子の細孔内でCO2が生成されると、細孔内の炭素との反応によりCOに急速に再生され、反応を継続させることができます。
残念ながら、炭素堆積反応も特定の悪影響を与える可能性があります。この反応は、温度が約500℃から550℃の領域、たとえばスタックの下位レベルの外殻、または上部の内殻内に、活性鉄スポットに堆積することによって耐火物の分裂を引き起こす可能性があります。レベル。過剰な場合、炭素の堆積により鉱石のペレットや焼結物が粉々に砕け、ガスの流れが不規則になり、負荷が不均一に降下する可能性があります。
炭素堆積反応は発熱反応であるため、出口ガスの温度が上昇します。炭素堆積反応の全体的な影響については議論の余地がありますが、特定の事実が残っています。この反応により、出口ガスのCO/CO2比が低下します。反応は一定量の炭素を再循環させますが、それ以外の場合は炉から実行されるため、炭素との反応に利用できる時間が長くなり、還元プロセスの化学的効率が向上します。
酸化鉄の還元
COによる酸化鉄の還元は、(i)3Fe2O3 + CO =2Fe3O4 + CO2、(ii)Fe3O4 + CO =3FeO + CO2、および(iii)FeO + CO =Fe+CO2の反応で表すことができます。これらの反応は、図1に示すように、COの割合がますます高くなるにつれて、ますます高温で達成されます。これは、比較的容易に達成できる反応(i)および(ii)が炉。鉄から最後の量の酸素を除去することを伴う反応(iii)は、実際に達成するのが最も困難であり、したがって、温度が高く、還元ガスのCO含有量が高い炉のさらに下で起こります。 570℃未満では、非化学量論的ウスタイト相(FexO)が不安定であり、マグネタイトを直接鉄に還元することが可能です。
特定の温度では、特定の酸化物の還元に必要なガス混合物に最小のCO含有量があります。これは、還元反応を継続する場合、ガス中のCO全体をCO2に変換することができないことを意味します。たとえば、800℃では、FeOおよび固体鉄と接触している平衡ガス混合物には約65%のCOと35%のCO2が含まれています。ガスのCO2含有量がこの温度でこの値を超えると、鉄は酸化されてFeOに戻る傾向があります。したがって、これらの反応が発生するためには、図1に示すように、各ステップでガス中のCO濃度が最小である必要があり、これらの反応によってCOを完全にCO2に変換することはできません。幸いなことに、これらの温度では、還元反応によって生成されたCO2はコークスの存在下では不安定であり、COは反応CO2 + C =2COに基づいて再生されるため、還元反応を継続できます。この反応と反応(iii)の組み合わせは、炭素によるFeOの「直接」還元(FeO + C =Fe + CO)に対応し、これは強力な吸熱反応であることに注意してください。
酸化鉄の還元は、羽口から注入された補助燃料の部分燃焼によって生成され、COと水素の2つの還元ガスを生成する水素によっても発生する可能性があります。水素は、炉の制御を補助するために蒸気が爆風に追加されたときにも生成されます。熱風での酸素による炭素の酸化によるCOの生成は発熱性ですが、コークスによる水分の還元によるCOと水素の生成(H2O + C =CO + H2)は非常に吸熱性です。
水素による酸化鉄の還元は、再び連続的に進行します。反応は、(i)3Fe2O3 + H2 =2Fe3O4 + H2O、(ii)FeO + H2 =Fe + H2O、および(iii)Fe3O4 + H2 =3FeO+H2Oです。これらの反応平衡に対する温度の影響を図1に示します。反応(i)はわずかに発熱性ですが、反応(ii)と(iii)は吸熱性です。サイズが小さいため拡散率が高い水素の存在は、BFガスの密度と粘度を著しく低下させ、特に高温では、還元性の低い原材料の削減を促進します。水性ガスシフト反応(CO2 + H2 =H2O =CO)は、気相のさまざまな成分間で発生して、水素含有ガスと炭素含有ガスを平衡状態にすることができます。
図1から明らかなように、炉を通過するガスは、コークス中の炭素と平衡状態になり、同時に下降負荷の酸化鉄と平衡状態になることはありません。約800℃を超えると、ガスと炭素との反応は酸化物よりも速く、コークスと気相の間の平衡はおそらくかなり密接に近づきます。操業炉内のガスの温度と組成の測定は、それらが800℃以上でCO/CO2-CラインとFeO/Feラインの間に落ち、600℃と800℃の間でFeO/Feラインを切断する傾向があることを示していますその後、Fe3O4/Feラインまたはそのすぐ上に留まります。 600℃未満の温度では、ガスの流れが非常に速いため、固体との反応にほとんど時間がかからず、ガスのCO含有量は、コークスと平衡状態にあるものをはるかに超えています。
酸化鉄が他の酸化物と化学的に結合している場合、BFでのその活性は低下します。これは、酸化鉄の還元がより困難であり、必要なCO/CO2比がここで通常考慮されているものよりも高いことを意味します。たとえば、ケイ酸第一鉄の場合、700℃での還元に必要な最小CO / CO2比は、炭素質ガスベースで約1.5から約22、つまり約60%COから約96%COに増加します。複合酸化物は還元がより困難であるため、還元にはより高い温度が必要であり、したがって、スラグ形成が起こる前にCOで達成される還元量は減少する。これは、炉の下部で必要な削減量が増えるため、コークス率が上がることを意味します。
ボッシュとハースでの反応
他の酸化物の還元 –生成物が純金属の場合、MnO + CO =Mn + CO2の反応は平衡状態でCOの割合が非常に近いため、酸化鉄やシリカなどの酸化鉄よりも安定した酸化物の還元はBFでは起こりません。 100%まで。つまり、還元の効率は非常に低く、非常に少量のマンガンを還元するには大量のガスが必要です。シリカは非常に安定した酸化物であるため、シリカの状況はさらに極端です。ただし、マンガンとシリコンを鉄に溶解することにより、MnO + CO =Mn(鉄に溶解)+ CO2、およびSiO2 + 2CO =Si(鉄に溶解)+ 2CO2の反応がやや右に移動し、金属とスラグの間のマンガンとシリコンの分布。これはスラグの組成と温度の関数です。これらの元素の両方の還元は吸熱性であるため、溶銑中のそれぞれの量は温度とともに増加し、反応の程度は炉の炉床の温度を制御することによってある程度制御されます。より重要なのは、これらの反応によって生成されるCO2がブドゥアール反応によって反応し、コークス消費量の増加を引き起こすという事実です。
還元されるマンガンの量は、明らかに投入された鉱石の量にも依存します。最大2%のマンガンを含む鉱石は、溶銑中の通常のマンガン含有量よりもはるかに高く、その結果、生成される溶銑1トンあたりのコークス率が高くなります。炉の不規則な負荷または温度変化によって引き起こされるシリコンの「スイング」もまた別の深刻な影響を与える可能性があります。シリコンは溶銑に還元されてスラグから枯渇するため、塩基度比が増加し、融点が変化します。スラグの流動性は時々劇的になります。
一酸化ケイ素(SiO)形成の影響 – For several years it was considered that silica and manganese oxide are reduced directly from the slag by reaction with carbon in iron according to the reactions (i) SiO2 (slag) + 2C =Si + 2CO (g), and MnO (slag) + C =Mn + CO (g). It was thought that liquid iron droplets picked up silicon as they passed through the slag phase and on into the hearth. Various studies however, have shed new light on these reactions and also those involving sulphur. Several laboratory studies together with plant data have shown that at the temperature of the combustion zone, around 2,000 deg C, SiO gas is produced during the combustion of coke by the reaction SiO2 (coke ash) + CO =SiO (gas) + CO2. Combining this equation with the reaction for coke oxidation [CO2 + C (coke) =2CO] yields the overall reaction SiO2 (coke ash) + C (coke) =SiO (gas) + CO. While the presence of FeO in slag is likely to make SiO formation from slag very difficult, an additional source of silica is to be reduced silica-rich slag adhering to the coke particles. Following these reactions, silicon is transferred to iron droplets by reaction with SiO in the gas phase [SiO (gas) + C =Si + CO]. As iron droplets containing silicon pass through the slag layer, some of the silicon is oxidized by iron oxide and manganese oxide, and taken up by the slag [2FeO (slag) + Si =SiO2 (slag) + 2Fe, 2 MnO (slag) + Si =SiO2 (slag) + 2Mn.
Reduction of phosphorus – It is expressed by the reaction P2O5 + 5C =2P + 5CO; delta H =+995,792 kJ/kmol. The final reduction of phosphorus also takes place only at very high temperatures. However, unlike manganese and silicon the phosphorus is essentially completely reduced. For this reason, virtually all of the phosphorus in the charge is dissolved in the hot metal. The only means of controlling the phosphorus content of the hot metal is by limiting the quantity charged to the furnace.
Behaviour of sulphur – Sulphur is a troublesome element in BF operations since hot metal for steelmaking is to be low in sulphur. Levels of 0.035 % to 0.02 % are normal. The reaction by which sulphur is removed from liquid iron (S ) into the slag (S) is frequently represented by the reaction S + (CaO) + C =(CaS) + CO (g) Where sulphur (S ) and carbon (C ) in the metal react with lime (CaO) dissolved in the slag to form calcium sulphide in the slag and CO gas. The distribution of sulphur between slag and metal, (S) /S , is strongly influenced by a number of factors as described here. Increasing the basicity of the slag (CaO / SiO2 ratio) tends to raise the thermodynamic activity of CaO in the slag which pushes reaction to the right. An increased oxygen potential in the system pushes the reaction to the left. This is shown by rewriting the reaction S + (CaO) =(CaS) + O 。 This effect is very strong, and the presence of even small concentrations of FeO in the slag seriously limits the sulphur ratio (S) / S 。 Fortunately both silicon and carbon raise the thermodynamic activity of sulphur in hot metal by 5 times to 7 times. Accordingly, sulphur in hot metal is 5 times to 7 times easier to remove than it is from liquid steel which contains relatively little carbon and silicon.
Assuming sulphur in coke ash is present as CaS, the reaction which can occur with SiO in the combustion zone to form volatile SiS is CaS (coke ash) + SiO (gas) =CaO + SiS (gas). To a lesser extent, some CS gas can form by the reaction CaS (coke ash) + CO =CaO + CS (gas).
Sulphur transfer from these volatile species to liquid iron droplets then takes place within the bosh zone. A study has shown that when iron droplets containing silicon and sulphur are allowed to fall through the liquid slag, in the absence of MnO, the silicon content of the hot metal actually increases, and there is no transfer of sulphur. In the presence of MnO, silicon is removed from the metal by reaction and manganese transfers from slag to metal together with sulphur transfer from metal to slag take place. Based on the various results available, the sequence of reactions in the bosh and hearth are (i) the formation of SiO and SiS in the combustion zone, (ii) the transfer of silicon and sulphur to metal and slag droplets in the bosh, (iii) the oxidation of silicon by FeO and MnO in the slag as the iron droplets pass though the slag layer, and (iv) the desulphurization of metal droplets as they pass through the slag layer.
The sulphur distribution ratios found in the BF normally varies between 20 and 120. On the other hand experiments have shown that when metal and slag samples from BF are remelted in graphite crucibles at 0.1 MPa CO, the distribution ratio increases to between 120 and 220, depending on the slag basicity. This suggests that the oxygen potential of the system is higher than is to be expected for C-CO equilibrium in the furnace hearth. Hence, while thermodynamic conditions favour sulphur removal from the hot metal within the BF, kinetic considerations imply that the reaction can be more readily accomplished outside the furnace by external desulphurization.
Reaction of less abundant elements
In addition to the elements (that is Fe, P, Mn, Si, Al, Ca, Mg and S) which are normally considered in reporting the chemical composition of an iron-bearing material, there are a number of less abundant elements which undergo chemical reactions in the BF. Some of these can cause considerable operating difficulty and some can contaminate the product and make it unsuitable for certain steelmaking applications. The source of these elements is not only from natural iron ores, but also from waste materials such as scrap, steelmaking dust, and grindings etc., which are recycled through the BF. Some of the more important of these elements are arsenic, barium, chlorine, chromium, cobalt, copper, fluorine, lead, molybdenum, nickel, potassium, sodium, tin, titanium, vanadium and zinc.
Alkalis and zinc – Sodium, potassium and zinc, frequently called the ‘rogue elements’, can cause serious operating problems in the BF and are to be monitored and carefully controlled if stable conditions are to be maintained. The alkali metals enter the BF as the constituents of the gangue in the ore and also as a part of the coke ash, normally as silicates. In the stack of the furnace, the silicates react as per the equations (i) K2SiO3 + CO =2K + SiO2 + CO2 and (ii) Na2SiO3 + CO =2Na + SiO2 + CO2.
In the BF, the potassium reaction can take place above 500 deg C, while the sodium reaction occurs at around 600 deg C. At temperatures of around 900 deg C, the alkali metals are above their boiling point so they join the gas phase. However, as these gases start to rise up the furnace, the metal becomes unstable with respect to other compounds which can form and cyanides, oxides, and carbonates all start to precipitate from the gas phase as very fine fumes or mists, since the cyanides are liquid over a wide temperature range. These fine particles of solid and liquid can deposit on the iron ore particles, the coke, and the furnace wall, with some, of course, being swept out with the BF gas and being captured in the dust catching system. Particularly the liquid alkali compounds can penetrate the brick lining of the furnace and cause serious deterioration and spalling. As well, these compounds can build upon the wall and cause scaffolding, hanging, and slipping.
The alkalis which land on the iron and coke are carried to the lower part of the furnace. There, they are again reduced to the metal which rises up the stack as a gas, forms the same alkali compounds, and repeats the cycle, joining new material in the process. The reduction needs carbon, increasing the coke rate, and cooling the furnace, and the recycling material can build up to the point where it degrades the coke in the furnace, causing it to break into small pieces and increasing the reactivity of the coke to CO2.
This increased reactivity can again reduce the temperature of the furnace and decrease the heat efficiency of the whole system. The high concentration of alkalis in the furnace also affects the strength and reduction characteristics of the iron bearing materials, causing dramatic swelling and catalyzing carbon deposition on the pellets. These deleterious reactions with both the coke and the ore can have serious impacts on the gas permeability in the furnace and on the stability of the BF operation.
Fortunately, the alkali oxides are very basic oxides and can be fluxed with SiO2 in acid slags and removed from the furnace. Normally, decreasing the slag basicity can carry increasing quantities of alkali away in the slag. This is in direct contrast to sulphur removal, where increasing the slag basicity increases the sulphur removal. When majority of desulphurizing takes place in the BF, there is a conflict between the attainment of low sulphur and removal of alkalis and the basicity of the furnace is carefully controlled to balance both the problems. With external desulphurization, this is no longer a problem and the furnace can normally be burdened to minimize alkali attack.
Zinc normally originates in steelmaking off-gas dust from furnaces using galvanized scrap which in some fashion has been recycled to the BF. Occasionally, the zinc content of iron ores or coal ash can be also a considerable source. Behaving not unlike sodium, zinc is reduced from the oxide or ferrite at around 600 deg C, forms a vapour which subsequently forms oxides or carbonates that can react with the sidewalls or be carried down the furnace on coke or ore to be reduced and further cycled, consuming coke at each turn. Zinc which escapes as a fume in the gas stream, enters the BF filter-cake, making it unsuitable to recycle if present in a high enough percentage. Unlike the alkalis, zinc is not captured to any extent in the slag and can only effectively be removed by decreasing the input and allowing the recycling vapour to slowly leave through the gas phase.
Clearly, the best protection against alkali metals and zinc is to ensure that the absolute minimum is part of the BF feed. Because of the tendencies of these elements to circulate in the furnace, they are unseen and unknown consumers of coke and cause refractory, ore and coke problems. Unfortunately, the symptoms of the problem are not always evident until the problem is of fairly major proportions and then needs fairly drastic measures, such as eliminating certain feed materials, to affect a solution.
Lead and titanium – Lead is seldom a problem in the BF but occasionally enough can enter a BF through the ore or sinter to cause a problem. Lead is very easily reduced in the iron BF and falls to the bottom of the hearth which normally has a chilled hot metal layer which protects the hearth refractories. Lead has virtually no solubility in the hot metal so it forms a low melting point liquid pool on which the hot metal floats, and hence promotes more rapid attack on the hearth. In certain furnaces where this problem is known to occur, a second tap-hole, deeper than the iron notch, can be used to periodically tap the lead.
Titanium is an even more stable oxide than silica but in the BF it can form extremely stable carbides and nitrides. The titanium compounds, if present in small quantities can be effective in forming a light protective layer on the hearth surfaces and prolong the life of the hearth. For this reason, titani-ferrous ores are added judiciously to sinter mixes. However, at high concentrations, these same compounds can stiffen the slag while building up a heavy hearth layer, reducing the hearth capacity of the furnace. As with zinc, the best solution is to reduce the input and slowly eliminate the titanium from the furnace.
Arsenic – Arsenic is found in a number of iron ores. The behaviour of arsenic is very much like that of phosphorus, in that it is almost completely reduced and dissolves in the hot metal. It increases the fluidity of the hot metal and hence, it appears to increase the wear of refractories. It is not completely removed during the steel refining process and imparts brittleness to the finished steel.
Barium – Barium is chemically similar to calcium and occurs as a very basic oxide in some iron and manganese ores. It is not reduced in the BF but becomes part of the slag, increasing the slag basicity. It can cause difficulty in controlling the metal composition if the operator is not aware of its presence.
Chlorine – Chlorine occurs as alkali chlorides in several iron ores and as a contaminating compound in ores processed with sea water. Chlorine is also present in some coals used for injection. In the high temperature zone of the BF, these compounds are volatized and as they rise toward the top of the furnace they condense around cooling plates and cause corrosion. They can also condense in uptakes and down-comers where they form accretions which can eventually restrict the passage of the top gas, or react to form HCl (hydrochloric) acid and attack the gas cleaning system.
Chromium – Chromium is found in some ores and is reduced to a certain extent depending on the basicity of the slag and the operating temperature. Normally, around 50 % to 60 % of the chromium is reduced into the hot metal.
Cobalt, copper, and nickel – Cobalt, copper, and nickel occurs in several different ores. They are also present in iron-bearing tailings from the copper industry which are sometimes sintered and used in the BF to recover the iron. All three of these elements are reduced almost completely into the hot metal and are not oxidized in the steel refining process. As a result, in operations which produce steel which is to meet stringent ductility specifications, such ores cannot be used.
Fluorine – Fluorine compounds are found in several ores and behave somewhat like chlorine compounds. The ability of HF (hydrofluoric) acid to attack the gas cleaning system is well known.
Molybdenum and tungsten – Molybdenum and tungsten occur very rarely and only in such minute quantities that they can be ignored. If any compounds of these elements are present in the BF, they are at least 90 % reduced into the hot metal.
Tin – Tin is an element which enters the BF mostly by way of recycled materials such as scrap or sintered dusts. It is almost entirely reduced and dissolves in the hot metal.
Vanadium – Vanadium occurs and behaves in a manner somewhat similar to chromium. Around 50 % of the vanadium in the burden is reduced and enters the hot metal.
Selenium and tellurium – Selenium and tellurium, though somewhat rare, can be present in some raw materials. In their reactions they are similar to sulphur but possess an even greater tendency to remain with the metal.
Fluxes
Limestone charged to the furnace is calcined by the reaction CaCO3(s) =CaO(s) + CO2 (g); delta H =177.8 kJ at around 800 deg C. Magnesium carbonate in the dolomite of the charge is calcined by a similar reaction MgCO3(s) =MgO(s) + CO2(g); delta H =167.4 kJ at 50 deg C to 100 deg C lower temperatures. These reactions result in several undesirable conditions in the furnace. The first is that they need considerable heat and the second is that CO2 is released in the furnace. The additional CO2 raises the oxygen potential of the gases which inhibits the final step in the reduction of the iron ore, i.e., FeO to Fe. It also favours ‘solution’ of carbon from the coke by the equation CO2 (g) + C(s) =2CO (g).
A considerable improvement in the furnace operations is achieved when ‘self-fluxing’ agglomerates of iron-ore concentrates are the principal iron-bearing charge to the furnace. Limestone and dolomite can be added to the feed of sintering machines and pelletizing furnaces. When the sinter is fired and the pellets are indurated, the fluxes are calcined and reacted with iron oxides to form calcium-ferrites and other more complex compounds. The CaO and MgO carried into the BF by these agglomerates are then free of CO2.
Slags
BFスラグの基本は複雑です。約40%で、酸素はスラグの最大の単一元素です。 Slag is, hence, an oxide system and ionic in nature. BFスラグの基礎を形成する酸化物システムは、スラグに特定の割合のMgOが存在するために変更された石灰-シリカ-アルミナ(CaO-SiO2-Al2O3)システムです。 Fig 4 show phase diagram of CaO-Al2O3-SiO2-10 % MgO system. BFプロセスの性質上、スラグ形成は、組成と温度の大幅な変化を伴う多段階プロセスです。 The four primary components of slags form numerous compounds which result in a wide range of chemical and physical properties. The lesser components of slag are of particular interest with respect for hot metal chemistry and furnace control, and add to the complexity of the physico-chemical properties of the slag.
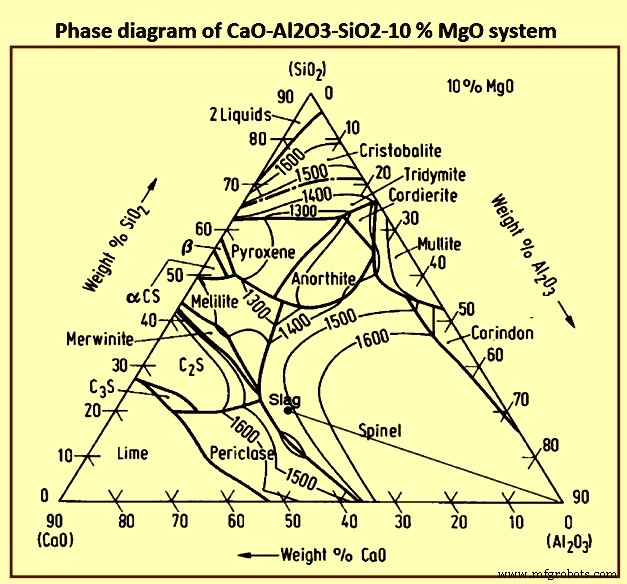
Fig 4 Phase diagram of CaO-Al2O3-SiO2-10 % MgO system
Slags with compositions in the region of 40 % SiO2, 48 % CaO, and 12 % A12O3 have low melting points, i.e., 1,300 deg C, and are appropriate for the control of sulphur and silicon in the hot metal. Frequently 6 % to 10 % MgO is used in place of an equivalent quantity of CaO to lower the viscosity of the slag. Small quantities of MnO, FeO, Na2O, and K2O etc. help to lower the melting point of the slag.
Essentially there are two slags in the furnace. The first is the ‘primary, or bosh, or early’ slag which is formed principally from the gangue constituents in the ores and agglomerates and CaO and MgO from the calcined fluxes, or the self-fluxing portions of the agglomerates. This slag is relatively basic compared to the final slag and contains some iron oxide. The ‘final or hearth’ slag is formed by the union of the early slag with constituents of the coke ash which are freed from the coke when it is burned before the tuyeres. This final slag continues to have its composition modified as it passes down into the hearth and mixes with liquid iron which also is flowing down into the crucible. There is an adjustment in the silica content of the slag, iron oxide can be reduced from it and it can absorb sulphur from the coke and liquid iron.
The formation of slags in the slag-formation zone is very furnace specific due to the impact of burden properties and furnace operation.スラグ形成ゾーンは、負担の緩和が始まる凝集ゾーンから始まり、羽口の高さより下まで続きます。したがって、スラグ形成ゾーンには、凝集ゾーン、アクティブコークスゾーン、デッドマン、およびレースウェイが含まれます。スラグ形成ゾーンの上部に形成されるスラグは「ボッシュ」または「プライマリ」スラグと呼ばれ、下部のゾーンを離れるスラグは「炉床」スラグです。 The Primary slag is normally assumed to be made up of all burden slag components including the iron oxides not reduced in the granular zone, but does not include the ash from the coke or injected coal.スラグの組成は、コークス灰と石炭灰、硫黄とケイ素がガスから吸収され、酸化鉄が還元されるため、炉内を下降するにつれて変化します。スラグの温度は、羽口の高さまで下がるにつれて500℃のオーダーで上昇します。これらの組成と温度の変化は、スラグの物理的特性、特に液相線温度と粘度に大きな影響を与える可能性があります。
The slag produced in slag formation zone collects in the slag layer in the hearth zone, filling the voids in the hearth coke and ‘floating’ on the hot metal layer.溶銑はスラグ層を通過して溶銑層に到達します。 The high surface area between the hot metal and slag as the hot metal passes through the slag layer enhances the kinetics of the chemical reactions.これらの反応は、溶銑の化学的性質にかなりの変化をもたらします。 In particular the (Si) and (S) contents prior to entering the slag layer are much higher than those in the hot metal layer.
製造プロセス



